stdClass Object
(
[nazev] => Ústav učitelství chemie a humanitních věd VŠCHT Praha
[adresa_url] =>
[api_hash] =>
[seo_desc] =>
[jazyk] =>
[jednojazycny] =>
[barva] =>
[indexace] => 1
[obrazek] =>
[ga_force] =>
[cookie_force] =>
[secureredirect] =>
[google_verification] => UOa3DCAUaJJ2C3MuUhI9eR1T9ZNzenZfHPQN4wupOE8
[ga_account] =>
[ga_domain] =>
[ga4_account] => G-VKDBFLKL51
[gtm_id] =>
[gt_code] =>
[kontrola_pred] =>
[omezeni] => 0
[pozadi1] =>
[pozadi2] =>
[pozadi3] =>
[pozadi4] =>
[pozadi5] =>
[robots] =>
[htmlheaders] =>
[newurl_domain] => 'kuhv.vscht.cz'
[newurl_jazyk] => 'cs'
[newurl_akce] => '[cs]'
[newurl_iduzel] =>
[newurl_path] => 8547/4154/1408
[newurl_path_link] => Odkaz na newurlCMS
[iduzel] => 1408
[platne_od] => 15.04.2024 22:09:00
[zmeneno_cas] => 15.04.2024 22:13:38.042557
[zmeneno_uzivatel_jmeno] => Martin Čapek Adamec
[canonical_url] =>
[idvazba] => 1717
[cms_time] => 1752308735
[skupina_www] => Array
(
)
[slovnik] => stdClass Object
(
[aktualizovano] => Aktualizováno
[logo] =>  [autor] => Autor
[drobecky] => Nacházíte se: VŠCHT Praha – KUHV
[top_search_placeholder] => hledat...
[more_info] => více informací
[social_fb_odkaz] =>
[social_fb_title] =>
[social_tw_odkaz] =>
[social_tw_title] =>
[social_yt_odkaz] =>
[social_yt_title] =>
[paticka_budova_a_nadpis] => BUDOVA A
[paticka_budova_a_popis] =>
[paticka_budova_b_nadpis] => BUDOVA B
[paticka_budova_b_popis] => Sídlo katedry najdete ve 3. patře nástavby X
[paticka_budova_c_nadpis] => BUDOVA C
[paticka_budova_c_popis] =>
[paticka_budova_1_nadpis] => NÁRODNÍ TECHNICKÁ KNIHOVNA
[paticka_budova_1_popis] =>
[paticka_budova_2_nadpis] => STUDENTSKÁ KAVÁRNA CARBON
[paticka_budova_2_popis] =>
[paticka_adresa] => VŠCHT Praha
[autor] => Autor
[drobecky] => Nacházíte se: VŠCHT Praha – KUHV
[top_search_placeholder] => hledat...
[more_info] => více informací
[social_fb_odkaz] =>
[social_fb_title] =>
[social_tw_odkaz] =>
[social_tw_title] =>
[social_yt_odkaz] =>
[social_yt_title] =>
[paticka_budova_a_nadpis] => BUDOVA A
[paticka_budova_a_popis] =>
[paticka_budova_b_nadpis] => BUDOVA B
[paticka_budova_b_popis] => Sídlo katedry najdete ve 3. patře nástavby X
[paticka_budova_c_nadpis] => BUDOVA C
[paticka_budova_c_popis] =>
[paticka_budova_1_nadpis] => NÁRODNÍ TECHNICKÁ KNIHOVNA
[paticka_budova_1_popis] =>
[paticka_budova_2_nadpis] => STUDENTSKÁ KAVÁRNA CARBON
[paticka_budova_2_popis] =>
[paticka_adresa] => VŠCHT Praha
Technická 5
166 28 Praha 6 – Dejvice
IČ: 60461373
DIČ: CZ60461373
Datová schránka: sp4j9ch
Za informace odpovídá: Ústav učitelství a humanitních věd
Technický správce: Výpočetní centrum
Copyright VŠCHT Praha
[paticka_odkaz_mail] => mailto:Ladislav.Nadherny@vscht.cz
[logo_href] => /
[stahnout] => Stáhnout
[google_search] => 001523547858480163194:u-cbn29rzve
[paticka_mapa_alt] =>
[novinky_kategorie_1] => Akce VŠCHT Praha
[novinky_kategorie_2] => Důležité termíny
[novinky_kategorie_3] => Studentské akce
[novinky_kategorie_4] => Zábava
[novinky_kategorie_5] => Věda
[novinky_archiv_url] => /novinky
[novinky_servis_nadpis] => Nastavení novinek
[novinky_dalsi] => zobrazit další novinky
[dokumenty_kod] => Kód
[dokumenty_nazev] => Název
[dokumenty_platne_od] => Platné od
[dokumenty_platne_do] => Platné do
[archiv_novinek] => Archiv aktualit
[intranet_odkaz] => http://intranet.vscht.cz/
[intranet_text] => Intranet
[logo_mobile_href] => /
[logo_mobile] =>  [mobile_over_nadpis_menu] => Menu
[mobile_over_nadpis_search] => Hledání
[mobile_over_nadpis_jazyky] => Jazyky
[mobile_over_nadpis_login] => Přihlášení
[menu_home] => Domovská stránka
[zobraz_desktop_verzi] => zobrazit plnou verzi
[zobraz_mobilni_verzi] => zobrazit mobilní verzi
[paticka_mapa_odkaz] =>
[nepodporovany_prohlizec] => Ve Vašem prohlížeči se nemusí vše zobrazit správně. Pro lepší zážitek použijte jiný.
[preloader] => Počkejte prosím chvíli...
[social_in_odkaz] =>
[hledani_nadpis] => hledání
[hledani_nenalezeno] => Nenalezeno...
[hledani_vyhledat_google] => vyhledat pomocí Google
[social_li_odkaz] =>
)
[poduzel] => stdClass Object
(
[1618] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[1620] => stdClass Object
(
[obsah] =>
[iduzel] => 1620
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1621] => stdClass Object
(
[obsah] =>
[iduzel] => 1621
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1622] => stdClass Object
(
[obsah] =>
[iduzel] => 1622
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
)
[iduzel] => 1618
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1619] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[1932] => stdClass Object
(
[nazev] => Ústav učitelství chemie a humanitních věd
[seo_title] => Ústav učitelství chemie a humanitních věd
[seo_desc] =>
[autor] => Ing. Ladislav Nádherný, PhDr. Martin Čapek Adamec, Ph.D.
[autor_email] =>
[obsah] =>
[mobile_over_nadpis_menu] => Menu
[mobile_over_nadpis_search] => Hledání
[mobile_over_nadpis_jazyky] => Jazyky
[mobile_over_nadpis_login] => Přihlášení
[menu_home] => Domovská stránka
[zobraz_desktop_verzi] => zobrazit plnou verzi
[zobraz_mobilni_verzi] => zobrazit mobilní verzi
[paticka_mapa_odkaz] =>
[nepodporovany_prohlizec] => Ve Vašem prohlížeči se nemusí vše zobrazit správně. Pro lepší zážitek použijte jiný.
[preloader] => Počkejte prosím chvíli...
[social_in_odkaz] =>
[hledani_nadpis] => hledání
[hledani_nenalezeno] => Nenalezeno...
[hledani_vyhledat_google] => vyhledat pomocí Google
[social_li_odkaz] =>
)
[poduzel] => stdClass Object
(
[1618] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[1620] => stdClass Object
(
[obsah] =>
[iduzel] => 1620
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1621] => stdClass Object
(
[obsah] =>
[iduzel] => 1621
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1622] => stdClass Object
(
[obsah] =>
[iduzel] => 1622
[canonical_url] => //kuhv.vscht.cz
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
)
[iduzel] => 1618
[canonical_url] =>
[skupina_www] => Array
(
)
[url] =>
[sablona] => stdClass Object
(
[class] =>
[html] =>
[css] =>
[js] =>
[autonomni] =>
)
)
[1619] => stdClass Object
(
[obsah] =>
[poduzel] => stdClass Object
(
[1932] => stdClass Object
(
[nazev] => Ústav učitelství chemie a humanitních věd
[seo_title] => Ústav učitelství chemie a humanitních věd
[seo_desc] =>
[autor] => Ing. Ladislav Nádherný, PhDr. Martin Čapek Adamec, Ph.D.
[autor_email] =>
[obsah] => Ústav učitelství chemie a humanitních věd je rektorátním útvarem VŠCHT Praha. Tvoří jej dvě pracovní skupiny: Skupina učitelství chemie a Skupina humanitních věd. Ústav zajišťuje výuku humanitních předmětů ve strukturovaném studiu na všech fakultách VŠCHT Praha a v programu
Učitelství chemie pro střední školy.
Studium v navazujícím magisterském programu je určeno pro absolventy bakalářského programu zaměřeného na chemii a poskytuje kvalifikaci pro výuku na středních školách a 2. stupni základních škol. Otevřena je prezenční forma studia, maximální počet přijímaných uchazečů je 30. Dvouleté studium je zakončeno obhajobou diplomové práce a státní závěrečnou zkouškou. Absolventi získají titul Mgr. a vysokoškolský diplom.
Studium v programu celoživotního vzdělávání je určeno pro posluchače magisterských programů na VŠCHT a pro absolventy vysokých škol s chemickým zaměřením. Studium probíhá v prezenční formě studia v nižším rozsahu než magisterské stuium (250 hodin). Toto studium je zakončeno obhajobou závěrečné práce a závěrečnou zkouškou. Absolventi obdrží osvědčení. Pro rok 2024/25 již uchazeče nebudeme přijímat.
Spolupráce se středními školami
Ústav spolupracuje s 23 pražskými středními školami v rámci zajišťování pedagogické praxe pro posluchače Učitelství chemie. Školy poskytující praxi ve větším rozsahu jsou:
- Gymnázium Praha 2, Botičská 1
- VOŠ zdravotnická a SZŠ, Alšovo nábřeží 6
- Gymnázium Elišky Krásnohorské
- Gymnázium Nad Štolou
- Arcibiskupské gymnázium v Praze
Učitelé učí učitele
3U je nově vzniklý projekt pro zkušené ale i začínající učitele chemie středních a základních škol, který zahrnuje tradiční Podzimní školu učitelů chemie, v loňském školním roce vzniklá Chemická centra VŠCHT Praha, newsletter Inspirace a Junior Club určený pro studenty učitelství, který bude propojovat studenty učitelství chemie se zkušenými kolegy, aby se mohli vzájemně obohacovat
Chemická centra VŠCHT Praha
Ve spolupráci s neziskovou organizací Elixír do škol jsme v září 2022 otevřeli 10 chemických center napříč celou republikou a v lednu 2023 jsme k nim přidali dalších pět. Centra jsou určena pro učitele chemie středních a základních škol a jejich hlavní náplní je získávání nových podnětů pro výuku v neformálním prostředí a sdílení svých zkušeností s kolegy. Od března 2023 fungují chemická centra pouze pod vedením VŠCHT.
Od září 2023 část center skončila, ale zároveň jsme otevřeli dalších 5 chemických center, a to v Ústí nad Labem, Mělníku, Jimramově, Olomouci a Kroměříži.
V září 2024 jsme otevřeli další 2 centra: v Praze (napůl v Praze 1 a 2) a v Plaňanech.
Bližší informace najdete zde.
Inspirace
Newsletter s nápady a inspirací do výuky pro učitele chemie (a nejen pro ně) vychází od poloviny září 2023 v průběhu školního roku.
0. číslo - červen 2023
[urlnadstranka] => [ogobrazek] => [pozadi] => [iduzel] => 1932 [canonical_url] => [skupina_www] => Array ( ) [url] => /home [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [81705] => stdClass Object ( [nazev] => Vzdělávací program pro provazející učitele [seo_title] => Vzdělávací program pro provazející učitele [seo_desc] => [autor] => Matyáš Kopecký [autor_email] => kopeckyy@vscht.cz [obsah] =>
Vážená paní učitelko, vážený pane učiteli,
Vážená paní ředitelko, vážený pane řediteli,
vážíme si naší dosavadní spolupráce v oblasti vzdělávání budoucích učitelů. Posíláme vám přednostně nabídku vzdělávacího programu pro provázející učitele. Tento program má omezenou kapacitu 20 míst.
Vzdělávací program svým rozsahem i obsahem odpovídá standardům Systému podpory provázejících učitelů MŠMT, v případě zájmu a vedení studujících na praxi se vaše škola bude moci od září 2025 přihlásit do pokusného ověřování MŠMT a získat tak finanční prostředky.
Komu je program určen?
- se podílejí na vedení pedagogické praxe studentů učitelství chemie a dalších přírodovědných předmětů,
- mají pedagogickou kvalifikaci, tj. předpoklady pro výkon činnosti pedagogického pracovníka podle § 3 Zákona č. 563/2004 Sb.04 Sb.,
- mají praxi ve výkonu přímé pedagogické činnosti v délce alespoň 5 let,
- mají podporu vedení své školy.
Jak je program organizován?
Vzdělávací program se skládá ze dvou částí:
- Vstupní vzdělávání v podobě intenzivního soustředění (20 hodin) 4.-5. dubna 2025 v hotelu Astoria v Jáchymově v krásném prostředí Krušných hor. Příjezd do objektu bude možný ve čtvrtek odpoledne 3. dubna, odjezd možný v neděli 6. dubna. Ubytování vč. snídaně je plně hrazeno, po příjezdu bude připraveno malé pohoštění.
- Průběžné vzdělávání rozdělené do pěti kratších bloků (celkem 20 hodin) na podzim 2025 v prostorách VŠCHT, vždy ve všední den odpoledne, podle časových možností účastníků.
Co můžete v programu očekávat?
- Praktické nástroje pro efektivní spolupráci se studujícími učitelství a zlepšování kvality výuky,
- podporu při rozvíjení kompetencí provázejících učitelů, jako je vedení reflektivního dialogu a společné plánování výuky,
- příležitost sdílet zkušenosti a získat inspiraci od kolegů a kolegyň,
- finanční podporu od září 2025 v rámci zařazení do pokusného ověřování MŠMT (v případě vedení studentských praxí).
Přihlášení do programu proveďte v registračním formuláři.
Srdečně vás i vaše kolegy učitele přírodovědných předmětů zveme k zapojení!
S pozdravem,
Petr Holzhauser, Jan Havlík, Karolina Duschinská
Vysoká škola chemicko-technologická
Ústav učitelství chemie a humanitních věd
Vzdělávací program je součástí řešení projektu OP JAK Podpora pregraduální přípravy budoucích učitelů a učitelek chemie na VŠCHT Praha (CZ.02.02.XX/00/23_019/0008466, začátek realizace 1.9.2024)

Státní závěrečná zkouška Specializace v pedagogice (dobíhající studium)
Informace pro studenty a zkouškové okruhy
Humanitní předměty
(vyučované v rámci všech studijních programů VŠCHT Praha)
Filozofie |
Dějiny
|
Právo |
Management |
Ekonomie |
Sociologie
|
Popularizace vědy
|
Politologie
|
Učitelství chemie
V souvislosti s novými studijními předpisy a novými akreditacemi studijních programů se mění i strategie přípravy budoucích učitelů chemie na VŠCHT Praha. Doposud výuka probíhala v tříletém bakalářském studijním programu Specializace v pedagogice se studijním oborem Učitelství odborných předmětů. Hlavní nevýhodou pro absolventy bylo, že podle zákona byli kvalifikováni pouze k výuce na středních odborných školách. Z toho důvodu bylo rozhodnuto, bude vytvořen nový, navazující magisterský studijní program Učitelství chemie pro střední školy. Absolventi tohoto dvouletého studijního programu získají titul Mgr. a budou plně kvalifikováni pro výuku na gymnáziích a druhém stupni základních škol.
Podmínkou pro přijetí je absolvovaný bakalářský studijní program chemického směru, absolvované konkrétní předměty společného základu nebo jejich ekvivalenty a úspěšně absolvovaný ústní přijímací pohovor. Přihlášky jsou přijímány do 31. 3. 2025 elektronicky prostřednictvím studijního informačního systému.
Od září 2021 je realizován program celoživotního vzdělávání (Učitelství chemie pro SŠ – studium v oblasti pedagogiky), jehož absolvováním mohou absolventi magisterského studia v chemických oborech získat kvalifikaci učitele chemie. Studium je třísemestrální v celkovém rozsahu 260 hodin, vč. 100 hodin reflektované praxe. Nové přihlášky do tohoto progamu již nejsou v roce 2024 přijímány.
[urlnadstranka] => [ogobrazek] => [pozadi] => [iduzel] => 17047 [canonical_url] => [skupina_www] => Array ( ) [url] => /ucitelstvi-chemie [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [17068] => stdClass Object ( [nazev] => Studium humanitních předmětů [seo_title] => Studium humanitních předmětů [seo_desc] => [autor] => Ing. Bohuslav Dušek, CSc. [autor_email] => [obsah] =>Předměty – informace o předmětech a studijní materiály
Význam humanitních předmětů pro studenty technických vysokých škol
Vytváření evropského prostoru VŠ vzdělávání a zapojení českých vysokých škol do mezinárodní sitě universit (Bolońská deklarace a předcházející úmluvy) předpokládá kompatibilitu struktury i obsahu studijních programů i výukových metod.
Zastoupení humanitních a ekonomických předmětů na technických universitách je podle západoevropských konvencí minimálně 1/10 výuky. VŠCHT Praha v tomto směru pokulhává. Změnou dříve povinně volitelných humanitních předmětů na volitelné (tedy nepovinné) byla přesunuta odpovědnost za tuto oblast vzdělání na studenty.
Technická zdatnost absolventů je pro profesní kariéru samozřejmě podmínkou nutnou, nikoliv dostačující. Zejména vedoucí funkce stále více vyžadují tzv. "soft skils", ke kterým patří dovednosti komunikativní, jednání s lidmi, sociologicko-psychologické znalosti, samozřejmě ekonomická gramotnost aj. Většina absolventů se domnívá, že je VŠ připravuje pro výkon povolání dostatečně po stránce odborné, ale jen velmi malá část považuje za dostatečnou přípravu v oblasti práce s lidmi. Tato část vzdělání je tedy doménou humanitních předmětů. Výuka humanitních předmětů v sobě organicky zahrnuje komunikativní dovednosti, diskusi, umění argumentace.
Naše škola, právě tak jako západní vysoké technické školy, nabízí studentům řadu humanitních předmětů především ve skupině volitelných předmětů. Studijní materiály jsou zpracovány tak, aby studium bylo realizováno moderními formami, které kladou důraz na relativně vysokou míru samostatnopsti práce studentů s redukovanými požadavky na prezenční formy výuky. Studenti si v jednotlivých semestrech mohou z nabídky společenskovědních předmětů volit na základě vlastních zájmů, potřeb a časových možností. Studentům, kteří uvažují o studiu učitelství chemie (viz dále) doporučujeme, aby si některý humanitní předmět zapsali již od 2. semestru.
Studijní materiály a organizační pokyny k většině předmětů jsou zde k disposici. Komunikace s vyučujícím je buď osobně v konzultačních hodinách nebo prostřednictvím e-mailu (kontakty).
[iduzel] => 17068 [canonical_url] => //kuhv.vscht.cz/studium-humanitnich-predmetu [skupina_www] => Array ( ) [url] => /studium-humanitnich-predmetu [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [16941] => stdClass Object ( [nazev] => Kontakty [seo_title] => Kontakty [seo_desc] => [autor] => [autor_email] => [obsah] => [urlnadstranka] => [ogobrazek] => [pozadi] => [iduzel] => 16941 [canonical_url] => [skupina_www] => Array ( ) [url] => /kontakty [sablona] => stdClass Object ( [class] => stranka_submenu [html] => [css] => [js] => [autonomni] => 1 ) ) [10499] => stdClass Object ( [nazev] => [seo_title] => Mapa stránek [seo_desc] => [autor] => [autor_email] => [obsah] => [iduzel] => 10499 [canonical_url] => //kuhv.vscht.cz/sitemap [skupina_www] => Array ( ) [url] => /sitemap [sablona] => stdClass Object ( [class] => sitemap [html] => [css] => [js] => [autonomni] => 1 ) ) [1485] => stdClass Object ( [nazev] => Stránka nenalezena [seo_title] => Stránka nenalezena (chyba 404) [seo_desc] => Chyba 404 [autor] => [autor_email] => [obsah] =>Chyba 404
Požadovaná stránka se na webu (již) nenachází. Kontaktuje prosím webmastera a upozorněte jej na chybu.
Pokud jste změnili jazyk stránek, je možné, že požadovaná stránka v překladu neexistuje. Pro pokračování prosím klikněte na home.
Děkujeme!
[urlnadstranka] => [ogobrazek] => [pozadi] => [iduzel] => 1485 [canonical_url] => [skupina_www] => Array ( ) [url] => /[error404] [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [10947] => stdClass Object ( [nazev] => Přístup odepřen (chyba 403) [seo_title] => Přístup odepřen [seo_desc] => Chyba 403 [autor] => [autor_email] => [perex] => [ikona] => zamek [obrazek] => [ogobrazek] => [pozadi] => [obsah] =>Nemáte přístup k obsahu stránky.
Zkontrolujte, zda jste v síti VŠCHT Praha, nebo se přihlaste (v pravém horním rohu stránek).
[urlnadstranka] => [iduzel] => 10947 [canonical_url] => [skupina_www] => Array ( ) [url] => /[error403] [sablona] => stdClass Object ( [class] => stranka_ikona [html] => [css] => [js] => [autonomni] => 1 ) ) [16960] => stdClass Object ( [obsah] => [iduzel] => 16960 [canonical_url] => [skupina_www] => Array ( ) [url] => [sablona] => stdClass Object ( [class] => dokumenty [html] => [css] => [js] => [autonomni] => 0 ) ) ) [iduzel] => 1619 [canonical_url] => [skupina_www] => Array ( ) [url] => [sablona] => stdClass Object ( [class] => [html] => [css] => [js] => [autonomni] => ) ) ) [sablona] => stdClass Object ( [class] => web [html] => [css] => [js] => [autonomni] => 1 ) [api_suffix] => )DATA
stdClass Object
(
[nazev] => Inspirace
[seo_title] => Inspirace
[seo_desc] =>
[autor] =>
[autor_email] =>
[perex] => 3U Inspirace je jednou z nových aktivit projektu 3U – Učitelé učí učitele, jejímž cílem je inspirovat vás a přinášet vám zajímavé, aktuální, praktické a ověřené tipy do výuky včetně návodů na pokusy a sdílení dobré praxe.
K odběru newsletteru se můžete přihlásit pomocí formuláře.
[ikona] =>
[obrazek] =>
[vyska] =>
[ogobrazek] =>
[pozadi] =>
[obsah] => Doplňky k newsletterům
2024
2023
[submenuno] => [drobeckyno] => [urlnadstranka] => [newurl_domain] => 'kuhv.vscht.cz' [newurl_jazyk] => 'cs' [newurl_akce] => '/cinnosti/3u/inspirace' [newurl_iduzel] => 72079 [newurl_path] => 8547/4154/1408/1619/16940/72077/72079 [newurl_path_link] => Odkaz na newurlCMS [iduzel] => 72079 [platne_od] => 26.01.2024 09:33:00 [zmeneno_cas] => 26.01.2024 09:33:36.60672 [zmeneno_uzivatel_jmeno] => Martin Čapek Adamec [canonical_url] => [idvazba] => 87997 [cms_time] => 1752307888 [skupina_www] => Array ( ) [slovnik] => Array ( ) [poduzel] => stdClass Object ( [81320] => stdClass Object ( [nazev] => Inspirace 3U – listopad/prosinec 2024 [seo_title] => Inspirace 3U – listopad/prosinec 2024 [seo_desc] => [autor] => [autor_email] => [obsah] =>Přiklopená svíčka
Co všechno ovlivňuje výšku hladiny při přiklopení svíčky nádobou?
Chemické složení svíčky
Svíčky se vyrábí nejčastěji z vosku (parafinového, včelího nebo rostlinného) nebo stearinu (rostlinného nebo živočišného). Nejlevnější a nejběžnější variantou je parafin získávaný rafinací ropy. Jedná se o směs nasycených alifatických uhlovodíků (alkanů) přibližně C20 až C40. Pro jednoduchost a základní úvahy o bilanci vznikajících produktů můžeme uvažovat svíčku z čistého parafinu o složení CnH2n+2. Vzhledem k tomu, že se vždy jedná o směs alkanů a počet atomů uhlíku je relativně vysoký, můžeme složení parafinu aproximovat stechiometrickým vzorcem CH2. Pak bude rovnice hoření následující:
2 CH2(s) + 3 O2(g) → 2 CO2(g) + 2 H2O(g)
Vzhledem k teplotě plamene svíčky (asi 800 °C) vzniká voda v podobě vodní páry (g). Pokud bychom přepokládali, že po uhasnutí svíčky počkáme tak dlouho, aby všechna voda zkondenzovala, pak ze 3 molů plynného kyslíku vznikají 2 moly plynného oxidu uhličitého. To je úbytek pouhých 7 % z celkového původního objemu vzduchu ve sklenici (obsah kyslíku ve vzduchu je 21 % obj., spotřebují se ho 2/3, tedy úbytek 7 %). To je příliš malá hodnota na vysvětlení pozorovaného úbytku objemu. (Pokud bychom připočítali zanedbané koncové atomy vodíku, zvýší se tato hodnota jen nepatrně.)
Kondenzace vody, zbytková vlhkost
Úvaha, že všechna vzniklá vodní pára zkondenzuje, také není přesná. Při zaklopení svíčky má vzduch vlhkost odpovídající vzduchu v místnosti, v zimě to může být ve vytápěném bytě 20 %, jinak se běžně pohybuje v rozmezí 40–60 %. Měřením se dá ukázat, že po skončení experimentu, když už se výška hladiny vody nemění, dosahuje hodnoty 70–80 %. Znamená to, že část vody vzniklé hořením zůstává v podobě páry a úbytek objemu vzduchu by měl být ještě menší než předchozí teoretická hodnota 7 %.
Rozpouštění CO2 ve vodě
Oxid uhličitý je omezeně rozpustný ve vodě a jeho rozpustnost silně závisí na jeho parciálním tlaku (tedy objemové koncentraci ve vzduchu, která se během experimentu mění) a teplotě. Hlavní je ale fakt, že rozpouštění do vody probíhá oproti době trvání experimentu pomalu a nemůže být zodpovědné za pohyb hladiny pozorovaný pouhým okem.
Tepelná roztažnost plynů
Doposud jsme neuvažovali, že hořící svíčka ohřívá vzduch v nádobě, ale hlavně generuje horký CO2 a vodní páru. Tedy ani v okamžiku přiklopení svíčky není možné předpokládat laboratorní teplotu vzduchu uvnitř nádoby. Přinejmenším, když svíčka zhasne, bude vzduch chladnout, zmenšovat svůj objem a významně přispívat ke zvýšení hladiny vody v nádobě. Ukazuje se, že vliv tepelné roztažnosti plynů je dominantní. Právě bublinky vzduchu unikající téměř vždy zpod nádoby při zaklopení jsou způsobeny ohříváním vzduchu uvnitř. Dalším důkazem je to, že hladina významně stoupá i potom, co svíčka zhasne (a kdy se přestane spotřebovávat kyslík). Navíc se před uhasnutím svíčky plamen významně zmenšuje, což snižuje rychlost nárůstu teploty plynů a chladnutí vzduchu v nádobě začíná dokonce už před zhasnutím plamene. Někdy je patrné, že po zhasnutí svíčky začne hladina stoupat skokově rychleji.
Neúplné spotřebování kyslíku
Zatím jsme předpokládali, že svíčka hoří tak dlouho, až se spotřebuje všechen kyslík. Tento předpoklad ale není samozřejmý. I pro hořlavé plyny (jako třeba methan) existuje určitá nutná minimální okolní koncentrace kyslíku, aby plyn dokázal hořet stabilním plamenem. Oprávněnost této námitky byla prokázána experimentálně tak, že do nádoby (zvonu) se svíčkou byla umístěna živá myš. Pokud by koncentrace O2 skutečně klesala k nule, bylo by to na chování myši poznat, v krajním případě by po delší době pokus nepřežila. Ve skutečnosti nebyla na myši ani po uhasnutí svíčky pozorována žádná výrazná změna chování. To by nasvědčovalo faktu, že se naopak velká část kyslíku nespotřebovala. I to bylo později pomocí elektronických čidel prokázáno, zbytková koncentrace O2 se pohybuje kolem hodnoty 17 % obj. To však znamená, že příspěvek úbytku kyslíku ke zvýšení hladiny je ještě výrazně menší než teoretická hodnota 7 % odpovídající jeho úplnému spotřebování.

Výška svíčky
Experimentálně bylo zjištěno, že za jinak stejných podmínek má vliv i výška svíčky. Čím je svíčka vyšší, tím hoří kratší dobu. Opět pomocí čidel byly měřeny koncentrace CO2 v průběhu experimentu v různých výškách nádoby. Nejvyšší nárůst koncentrace po přiklopení svíčky ukázalo měření v horní části nádoby přesto, že CO2 má vyšší hustotu než vzduch (jak se dá ukázat jinými experimenty se svíčkami). Vysvětlit se to dá tak, že na začátku vzniká horký CO2, který má hustotu menší než okolní vzduch, stoupá vzhůru a jeho koncentrace roste shora nádoby. Důsledkem toho vysoká svíčka zhasne jako první. Zajímavé je, že autoři neuvádějí vliv výšky svíčky na výšku hladiny v nádobě.
Nedokonalé spalování
Pokud se během experimentu plamen svíčky zmenšuje v důsledku zvyšování koncentrace CO2 a snižování koncentrace O2, bylo by možné uvažovat i částečné nedokonalé spalování parafinu za vzniku oxidu uhelnatého. V tomto případě by uhlík pro svoji oxidaci potřeboval polovinu kyslíku než při hoření na CO2:
1 C(s) + ½ O2 → 1 CO(g)
Dá se předpokládat, že pokud by se nedokonalé spalování uplatňovalo, tak jen relativně krátkou dobu před uhasnutím plamene. Spolu s faktem, že spotřeba kyslíku není hlavním faktorem ovlivňujícím konečnou výšku hladiny, to znamená, že vliv nedokonalého spalování bude jen velmi malý. Je třeba upozornit, že se jedná pouze o teoretickou úvahu, protože vznik CO (byť malého množství), nebyl experimentálně prokázán.
Na vánočním videu můžete vidět, že se experiment chová trochu jinak. Na začátku po přiklopení neunikají bublinky, plamen se zvětší a rozjasní a hoří nezvykle dlouho. Je to proto, že kádinka byla předem naplněna kyslíkem (nicméně plamen nehoří v čistém kyslíku, část ho při zaklopení vyteče).
Chemické vánoční stromečky
Chemikálie a pomůcky:
- dekahydrát tetraboritanu sodného (borax)
- zelený čistící dýmkový drát (lze koupit v kreativních potřebách)
- kádinka nebo zavařovací sklenice
- kancelářská sponka
- odměrný válec
- rychlovarná konvice
- špejle
- lžička
- navažovací lodička
- váhy
Postup

Tipy a triky:
- Roztok nevyléváme, uschováme ho v uzavřené popsané sklenici pro další krystalizaci. Pro další použití roztok přivedeme k varu v kádince a přidáme potřebné množství boraxu.
- Z dýmkového drátu můžeme vytvořit libovolné tvary a použít jako ozdoby na stromek.
- S pevným boraxem nemohou žáci ZŠ ani gymnázií pracovat ani pod dohledem učitele. Pro práci ve třídě doporučujeme následující rozdělení rolí: žáci vytvoří ozdoby z drátků a vyučující připraví nasycený roztok, do kterého připravené drátky ponoří.
- Jako žákovskou variantu lze využít například chlorid draselný. Jeho rozpustnost při 100 °C je 57 gramů na 100 gramů vody.
Skořicový aldehyd
Dvojná vazba přítomná v přírodním cinnamaldehydu má konfiguraci E (trans).
Cinnamaldehyd se snadno získá ze skořicové kůry destilací s vodní parou, případně aldolovou kondenzací benzaldehydu s acetaldehydem. Oba postupy jsou snadno proveditelné i ve školních laboratořích.
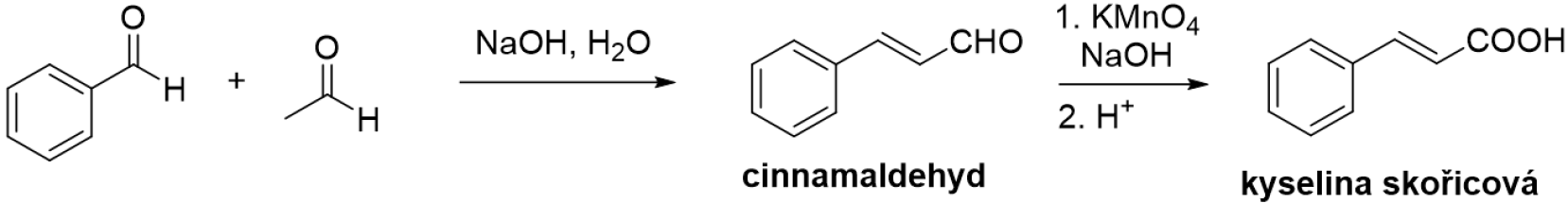
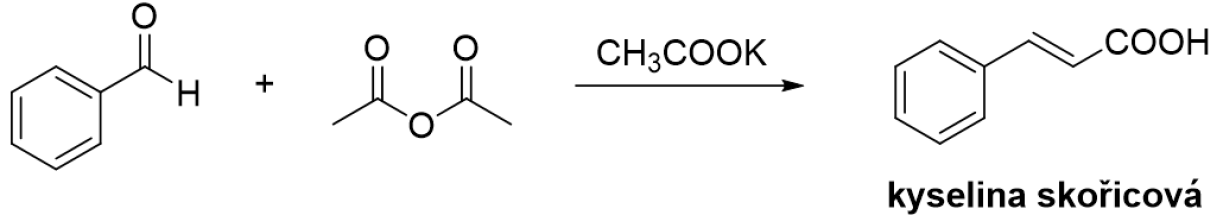
Kyselina skořicová se dá připravit oxidací cinnamaldehydu nebo Perkinovou reakcí z benzaldehydu a acetanhydridu v bazickém prostředí.
Věděli jste, že?
- Cinnamaldehyd je znám opravu dlouho – byl izolován ze skořicového esenciálního oleje J. Dumasem a E. Péligotem už v roce 1834 a laboratorně syntetizován L. Chiozzou v roce 1856.
- Čistý cinnamaldehyd dráždí kůži a ve větších dávkách je toxický (LD50 2 225 mg/kg pro myš, 2 220 mg/kg pro potkana).
- Skořice podporuje chuť k jídlu a zlepšuje trávení.
- V řadě kuchyní (asijské, latinskoamerické, arabské, španělské…) se skořice přidává do masitých pokrmů.
- Cinnamaldehyd byl využit i při falšování potravin. Bukvicové skořápky umleté na prášek a aromatizované cinnamaldehydem bývají vydávány za mletou cejlonskou skořici.
-pm-
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 81320 [canonical_url] => [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2024-11 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [79309] => stdClass Object ( [nazev] => Inspirace 3U – září/říjen 2024 [seo_title] => Inspirace 3U – září/říjen 2024 [seo_desc] => [autor] => [autor_email] => [obsah] =>Acetylsalicylová kyselina
Samotná kyselina salicylová se kvůli dráždění žaludeční sliznice jako analgetikum již nepoužívá. Dodnes se s ní ale setkáme v mastích a roztocích určených k odstranění svrchní části pokožky, zejména při odstraňování bradavic nebo akné.
Aspirin jako zázračný lék
Nejenže má aspirin výrazné analgetické, antipyretické a antiflogistické účinky, ale jeho dlouhodobé užívání snižuje riziko výskytu některých druhů rakoviny (plic, tlustého střeva, prostaty, prsu a dalších). Nízké dávky aspirinu v prvním trimestru těhotenství také výrazně snižují riziko vzniku preeklampsie, závažného onemocnění, které může vést k předčasnému porodu nebo i úmrtí plodu. V neposlední řadě se aspirin používá ke snížení rizika vzniku trombózy. I v případě této indikace stačí menší dávky, běžně se podává 100 mg denně, tedy pětina toho, co je podáváno ke snížení teploty.
Jak aspirin funguje?
Aspirin v těle inhibuje tvorbu prostaglandinů – látek, které jsou produkovány v místě poranění nebo zánětu. Prostaglandin PGE2 také ovlivňuje regulaci teploty a vyvolává horečku. Tromboxan A2 zase vyvolává agregaci destiček a srážení krve. Zablokováním syntézy těchto látek tak aspirin působí proti zánětu, vysoké tělesné teplotě a trombóze.
Trocha chemie na závěr
Kyselina acetylsalicylová se vyrábí acetylací kyseliny salicylové. K acetylaci je možné použít acetanhydrid nebo acetyl-chlorid, v praxi se dává přednost acetanhydridu, který je levnější a stabilnější vůči nežádoucí hydrolýze. Reakce je katalyzována kyselinou sírovou. Kyselinu salicylovou je možné získat tzv. Kolbeho–Schmidtovou reakcí. Ta spočívá v zahřívání fenolátu sodného s oxidem uhličitým za vysokého tlaku, při němž dochází ke karboxylaci aromatického jádra. Kyselina salicylová je pak ze sodné soli uvolněna působením kyseliny sírové.
ASPIRIN – Věděli jste?
- Ročně se ve světě prodá přibližně 40 000 tun aspirinu.
- Toxická dávka pro dospělého člověka je asi 10–30 g.
- Nejčastějším nežádoucím účinkem je podráždění žaludku.
- Vysoké dávky aspirinu mohou způsobit zvonění v uších.
- Byl hojně používán v období epidemie španělské chřipky (1918–1919) a traduje se, že jeho nadužívání v ohromných dávkách nejspíš přispělo k vysokému počtu obětí.
- Nesmí se podávat dětem do 12 let, u kterých hrozí riziko vzniku potenciálně smrtelného Reyova syndromu (poškození mozku a jater).
- Každý rok vychází přibližně 3 500 odborných článků zabývajících se aspirinem.
- Za objev a popis mechanismu účinku, tj. inhibice tvorby prostaglandinů, byla J. Vaneovi v roce 1982 udělena Nobelova cena.
-pm-
Tajný inkoust z acylpyrinu
Pomůcky a chemikálie:
- acylpyrin (nebo aspirin) 500 mg (1 tableta)
- hydroxid sodný (1 pecička)
- bílý ocet (nepřibarvený karamelem na hnědo) nebo 8% kyselina octová
- síran železitý
- zkumavka, nebo kádinka
- kahan, nebo plotýnka
- stříkačka 5 ml
- špejle nebo tenký štětec
- neklížený papír
- zdroj UV záření
- rozprašovač
- ochranné brýle, rukavice a ochranný oděv
Postup přípravy
Jako výchozí surovinu použijeme léčivo acylpyrin (aspirin), který je volně prodejný v lékárně. Jednu tabletku vložíme do zkumavky. Přidáme 2 ml vody (odměřené injekční stříkačkou) a jednu větší pecičku hydroxidu sodného. Směs zahřejeme nad kahanem a za stálého protřepávání udržujeme var alespoň jednu minutu. (Tento krok je klíčový: Příliš krátké nebo nedostatečné zahřívání bývá nejčastější příčinou nezdaru experimentu. Alternativně můžeme použít k rozpouštění i kádinku a ohřívat směs na elektrické plotýnce.) Po ochlazení směs zneutralizujeme přídavkem 2 ml bílého octa nebo 8% kyseliny octové a inkoust je hotový. Pokud je roztok zakalený, můžeme ho před použitím zfiltrovat např. přes kávový filtr nebo filtrační papír či nechat odstát a slít.
Během celé přípravy inkoustu pracujeme v ochranném oděvu, s brýlemi a v rukavicích. Hydroxid sodný je žíravina.
Čtení pod UV lampou
Účinnou složkou inkoustu je připravená kyselina salicylová. Tajný vzkaz můžeme napsat špejlí nebo tenkým štětcem se syntetických štětin, přírodní jsou citlivé na alkalické prostředí a mohou se rozkládat. Po zaschnutí je inkoust viditelný pouze při osvícení ultrafialovým zářením. Jako jeho zdroj můžeme použít malé svítilny, které se prodávají na ověřování pravosti bankovek nebo UV-LED lampy na vytvrzování umělých nehtů.
Běžné papíry pod UV zářením „svítí“, použijeme proto neklížený papír, který optické zjasňovače neobsahuje (piják, filtrační nebo akvarelový papír). Na něm bude modře svítit pouze napsaný tajný vzkaz. Jev, který pozorujeme, se nazývá fluorescence – látka, která fluoreskuje, pohltí záření o vyšší energii (v tomto případě neviditelné UV záření) a vyzáří světlo o energii nižší (zde modré světlo).
Vyvolání inkoustu pomocí železité soli
Inkoust na bázi kyseliny salicylové lze také snadno zviditelnit roztokem síranu železitého. Jeho přibližně 2% roztok jemně aplikujeme rozprašovačem na místo, kde předpokládáme přítomnost tajného písma a během krátké chvíle můžeme pozorovat intenzivní hnědočervené zabarvení vznikajícího komplexu. Při aplikaci pracujeme opatrně a na omyvatelném podkladu, protože železité soli zanechávají na dřevě a porézních materiálech špatně odstranitelné skvrny. Detailní postup včetně zajímavého rozšíření úlohy o přípravu síranu železitého z potravinových doplňků je k dispozici v následujícím odborném článku v časopise Journal of Chemical Education: https://pubs.acs.org/doi/10.1021/ed082p542. Pokud byste k němu neměli přístup přes Vaši školu nebo knihovnu, můžete si o detaily napsat na náš e-mail 3U-Inspirace@vscht.cz.
-jh-, -pH-
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 79309 [canonical_url] => [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2024-09 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [77898] => stdClass Object ( [nazev] => Inspirace 3U – červen 2024 [seo_title] => Inspirace 3U – červen 2024 [seo_desc] => [autor] => [autor_email] => [obsah] =>Přírodní fotografický papír
Postup
Co pozorujeme
Morfin a jeho příbuzní
Morfin jako lék
Morfin jako droga
Laudanum
Příbuzní morfinu
Trocha chemie na závěr
Slovníček
Opium: zaschlá šťáva získaná z nezralých makovic máku setého
Opioid: látka schopná vázat se na opioidní receptory, které se nachází primárně v centrální nervové soustavě
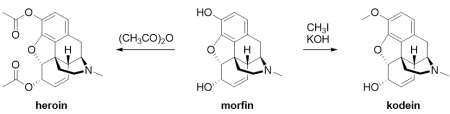
Opiát: alkaloid obsažený v opiu, látka buď přírodní, nebo polosyntetická, tedy připravená modifikací v přírodě se vyskytujícího opiátu; mezi hlavní opiáty patří morfin, kodein a thebain
OPIÁTY – věděli jste?
- Opioidní receptory se nacházejí také ve střevech. Na tom je založeno působení loperamidu (Imodium). Častým vedlejším účinkem při užívání opioidů je totiž zácpa. Loperamid jako syntetický opioid se váže na opioidní receptory ve střevech, a působí tak proti průjmům.
- Název opium pravděpodobně pochází z řeckého slova opion – maková šťáva nebo opos – rostlinná šťáva.
- Největším producentem opia je Afghánistán, jehož produkce je odhadována na 6 000 až 8 000 tun ročně.
- Nejkvalitnější opium pochází z oblasti tzv. zlatého trojúhelníku, tedy z Thajska, Myanmaru (Barmy) a Laosu.
- České republice a v mnoha dalších státech je výroba, držení a prodej heroinu nelegální, ale například ve Velké Británii je heroin pod jménem diamorphine k dostání na lékařský předpis.
- Heroin byl v letech 1898 až 1910 prodáván jako nenávyková náhražka morfinu a jako dětská medicína proti kašli. Až později bylo zjištěno, že se v játrech metabolizuje na morfin.
- Česko je největším pěstitelem máku pro potravinářské účely na světě. Potravinářský mák má podle tuzemské legislativy obsah morfinu jen 43 miligramů na kilogram, odrůdy máku pro farmaceutické účely, pěstované hlavně v zahraničí, obsahují morfinu i několik procent.
Samozahřívací polšářky
Pomůcky: kádinka nebo Petriho miska, mikrovlnná trouba
Chemikálie: 100 g trihydrátu octanu sodného, 25 ml destilované vody
Postup
K demonstraci tohoto efektního jevu postačí zahřát v kádince nebo Petriho misce směs přibližně 100 g trihydrátu octanu sodného zvlhčeného přibližně 25 ml destilované vody, dokud nedojde k rozpuštění všech krystalků. K ohřevu se nejlépe osvědčila mikrovlnná trouba. Můžeme ale použít i elektrickou plotýnku nebo vodní lázeň. Zcela roztavená směs se poté ponechá samovolně vychladnout na pokojovou teplotu. Krystalizace se aktivuje vhozením malého množství octanu sodného, nebo třením skleněné tyčinky o stěnu.
V případě, že máte k dispozici octan sodný pouze jako bezvodý, nebo se nedaří směs během chladnutí udržet kapalnou, je vhodné množství přidávané vody postupně navyšovat až do bodu, kdy u horkého roztoku přestanou být patrné zárodky krystalů vznikající na hladině.
Další typy polštářků
Z chemického hlediska jsou také velmi zajímavou alternativou jednorázové zahřívající polštářky založené na pozvolné oxidaci směsi pyroforického železa. Můžeme se s nimi nejčastěji setkat v podobě drobných zatavených sáčků v balení sušeného masa nebo arašídů. Na rozdíl od běžnějších sáčků obsahujících kuličky silikagelu není jejich hlavním účelem vázat vlhkost, ale lapat vzdušný kyslík, který by mohl způsobovat žluknutí. Jeden gram železa je totiž schopen na sebe navázat až 300 ml kyslíku. Díky exotermnímu charakteru této reakce můžeme její průběh sledovat v podobě vznikajícího tepla:

Porovnání záběrů z infrakamery s fotografií aktivované samozahřívací náplasti a jejího obsahu (nahoře) a čerstvě otevřeného sáčku absorbujícího kyslík v balení potravin (dole).
Samotné železo potřebuje k zahájení oxidace relativně vysokou vzdušnou vlhkost. Směs v sáčcích proto zpravidla obsahuje také chlorid sodný, který na sebe dokáže navázat i stopy vlhkosti a reakci urychlit. Další přísadou pak bývá i jíl nebo aktivní uhlí, které díky svému velkému povrchu slouží jako nosič i jako prostředek schopný vázat nepříjemné pachy.
Vedle konzervace potravin jsou větší verze těchto polštářků také využívány i jako samozahřívací náplasti pro léčbu bolavých zad. Jak je patrno i z porovnání teploty náplasti a jejího volně vysypaného obsahu vpravo nahoře na Obrázku 2, množství dostupného kyslíku je limitováno polopropustnou membránou. Nehrozí proto popálení v důsledku nadměrného množství uvolněného tepla a náplast vydrží rovnoměrně hřát až po dobu 12 hodin.

Komerční provedení samozahřívacích náplastí na bolavá záda založených na pozvolné oxidaci pyroforického železa.
Aluminotermická příprava železa – termit
Pomůcky: malý keramický květináč, nádoba na promíchání složek, alobal, stojan, křížová svorka, železný kruh, kýbl s pískem, ruční plynový hořák, kladivo, magnet, ochranné brýle, kožené rukavice
Bezpečnostní upozornění: Aluminotermická směs musí být dokonale suchá, jinak hrozí „vystřelení“ směsi ven z květináče a popálení přihlížejících osob. Při jejím zapálení se chráníme ochrannými brýlemi a koženými rukavicemi, reakci může demonstrovat pouze učitel chemie.
Postup
Oxid železitý a hliník odděleně předem vysušíme v sušárně (při teplotě 150 °C) nebo přes noc v tenké vrstvě na topení. Ve vhodné uzavíratelné plastové nádobě protřepáním dobře promísíme jemné hliníkové hobliny a suchý práškový oxid železitý v hmotnostním poměru 3 : 1. Dále připravíme zápalnou směs promísením peroxidu barnatého s práškovým hořčíkem v hmotnostním poměru 1 : 1. Otvor ve dně květináče zakryjeme přeloženým alobalem a vsypeme připravenou aluminotermickou směs.
Reakci provádíme venku!
Pod stojan se železným kruhem umístíme kýbl s pískem. Květináč s připravenou směsí vložíme do kruhu a jeho výšku nastavíme tak, aby dno květináče bylo asi 10 cm nad úrovní písku. Do středu směsi uděláme důlek a vsypeme zápalnou směs. Do jejího středu zasuneme hořčíkovou pásku tak, aby končila alespoň 4 cm nad povrchem směsi. V ochranných brýlích a v kožených rukavicích zapálíme konec hořčíkové pásky ručním plynovým hořákem a ustoupíme do vzdálenosti alespoň 3 metrů.
Jakmile hořčíková páska směs zapálí, pozorujeme prudkou reakci doprovázenou jiskrami vyletujícími z květináče:
2 Al + Fe2O3 → 2 Fe(l) + Al2O3 ΔrH° = −730 kJ mol−1
Po několika sekundách se alobal na dně květináče propálí a do písku vyteče kapalné železo rozpálené do jasně žlutého žáru. Květináč většinou žárem praskne. Po vychladnutí železa je možné kováním za pomoci kladiva oddělit křehkou strusku (Al2O3) a železo identifikovat pomocí magnetu.
Tipy a triky
- Reakci provádíme v malém množství nejvýše několika desítek gramů směsi (podle velikosti železného kruhu a květináče).
- Květináč musí do kruhu zapadnout alespoň polovinou svojí výšky.
- Pokud nemáme k dispozici peroxid barnatý nebo práškový hořčík, je možné termit zapálit reakcí manganistanu draselného a bezvodého glycerinu. Do důlku vsypeme krystalický manganistan draselný a zakapeme
jej takovým množstvím glycerinu, aby se do něj právě vsákl. K zapálení směsi dojde se zpožděním asi 30 až 60 sekund.
Jak to funguje
Termit je pyrotechnická směs (nejčastěji hliníku a oxidu železitého), která po zapálení prudce reaguje za uvolnění nezvykle velkého množství tepla. Reakční teplota je 2 000–3 000 °C, vznikající železo je tedy v kapalném stavu a může být rozžhavené až do bílého žáru.
Právě rychlé zvýšení teploty způsobuje riziko vystřelení směsi v případě použití vlhkých složek. Přítomná voda se během okamžiku vypaří, vodní pára mnohonásobně zvětší svůj objem a může vystřelit žhavé reagující složky i produkty.
-pH-
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 75516 [canonical_url] => [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2024-01 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [74684] => stdClass Object ( [nazev] => Inspirace 3U – prosinec 2023 [seo_title] => Inspirace 3U – prosinec 2023 [seo_desc] => [autor] => [autor_email] => [obsah] =>Žhnoucí měď
Pomůcky: vysoká kádinka 250 ml, hodinové sklo (na přikrytí kádinky), kancelářské sponky, silnější drát (přes kádinku), plynová pistole nebo kahan, rovné a kulaté kleště, štípačky
Chemikálie: aceton, měděný drát (průřez 1,5 mm2), měděný plech, pěticentová euromince nebo desetikoruna
Postup
Z měděného drátu nebo plechu vyrobíme objekt podle vlastní fantazie. Přes kádinku dáme tlustší drát pro zavěšení objektu. Z narovnané kancelářské sponky uděláme závěs tak dlouhý, aby náš objekt visel 0,5 cm nad dnem kádinky. Do kádinky nalijeme tolik acetonu, aby jeho hladina byla asi 3 mm pod měděným objektem. Stranou od kádinky s acetonem (hořlavina!) na závěsu rozžhavíme měděný objekt plynovou pistolí nebo nad plamenem kahanu a vložíme ho do kádinky s acetonovými parami. Původně zčernalý povrch mědi zrůžoví a pak se na něm začnou duhově měnit růžové až černé oblasti. Ve tmě objekt podle tloušťky a geometrie materiálu žhne tmavě červenou až oranžovou barvou. Pokud si z kancelářské sponky vytvarujeme vhodný závěs, dá se experiment udělat i pěticentovou euromincí nebo desetikorunou.
Důležité je, aby se měděný objekt nedotknul hladiny kapalného acetonu, došlo by pravděpodobně k jeho vznícení (zapálení). Pokud se tak nedopatřením stane, není třeba panikařit, kádinku zakryjeme hodinovým sklem a plamen sám zhasne.
Tipy a triky
- Čistý měděný drát získáme nejsnáze odizolováním elektrovodného kabelu s průřezem 1,5 mm2 (průřez 2,5 mm2 by fungoval také, ale hůř se ohýbá a tvaruje)
- Protože je měď měkká, dá se tenký měděný plech stříhat obyčejnými nůžkami. Pokud chcete dělat kulaté dírky, použijte průbojníky (používají se třeba na dělání děr do kožených pásků a dají se koupit v hobbymarketu).
- Pozor – ve výtvarných potřebách se prodávají fólie pro vytlačování obrázků označené jako „měděné“, ve skutečnosti jsou hliníkové, jsou podle všeho nalakovány, aby jako měď vypadaly (v plameni kahanu se červená vrstva rychle spálí) a pokus s nimi nefunguje.
Jak to funguje
Když měď vyžíháme v plameni, při chladnutí se kov pokrývá vrstvou černého oxidu měďnatého. Pokud drát nebo plech ještě dostatečně horký vložíme do kádinky s parami acetonu, začne probíhat oxidace acetonu vzdušným kyslíkem. Mechanismus je takový, že nejprve reaguje oxid mědnatý s acetonem, vznikají štiplavě zapáchající produkty a kovová měď (povrch předmětu zrůžoví, dobře patrné je to při vložení objektu do acetonových par). Oxidační reakce je silně exotermní a udržuje kov v rozžhaveném stavu, nebo ho dokonce zahřeje na vyšší teplotu, než měl při vložení – objekt se po chvilce rozžhaví.
Vzhledem k barvě žhnoucího měděného objektu je možné dosaženou teplotu odhadnout na až 1 000 °C (oranžová barevná teplota tepelně zářícího tělesa je asi 1 000 °C). Při této teplotě měď opětovně reaguje se vzdušným kyslíkem, znovu vzniká oxid měďnatý a cyklus se opakuje. Výsledkem je kontinuální heterogenní reakce acetonu s kyslíkem na povrchu mědi, jejíž reakční teplo udržuje kov v rozžhaveném stavu. Důležité je, aby měl měděný objekt při vložení do acetonových par dostatečnou teplotu. Každý katalyzátor totiž začne pracovat až od určité teploty (kdy je jeho reakce se substrátem dostatečně rychlá), pak už se teplota udržuje reakčním teplem. Pokud nám tedy měděný objekt před vložením do acetonových par příliš vychladne, reakce nezačne probíhat.
Při vhodném uspořádání může reakce a efektní žhnutí trvat desítky sekund nebo i minuty. Uplatňuje se totiž navíc jev, který je podobný tzv. komínovému efektu. Plynné produkty mají vysokou teplotu, také páry acetonu a vzduch v okolí objektu jsou zahřívány, rozpínají se a mají menší hustotu než chladnější plynná směs po obvodu kádinky. Tyto horké plyny stoupají středem kádinky vzhůru (je možné opatrně vyzkoušet rukou) a v důsledku toho se po obvodu okraje kádinky dovnitř nasává čerstvý vzduch. Žhnoucí objekt vyzařuje teplo radiací (sáláním), ohřívá aceton na dně kádinky a ten se odpařuje. Je tak zaručen kontinuální přísun reaktantů ke katalyticky aktivnímu povrchu mědi a reakce může probíhat relativně dlouhou dobu až do odpaření veškerého acetonu.
Stejně tak důležité je, aby měděný objekt nebyl příliš blízko hladiny acetonu nebo se jí nedotknul. Aceton má jako každá hořlavina tzv. teplotu vznícení, při které se definovaná směs par hořlaviny se vzduchem vznítí (pro aceton to je 465 °C), tzn. začne probíhat oxidace kyslíkem doprovázená otevřeným plamenem (hoření). Důvod, proč k tomu v případě našeho experimentu prakticky nikdy nedojde, je pravděpodobně ten, že plynná směs je v okolí měděného předmětu chudá na kyslík (oproti definovaným podmínkám při měření teploty vzplanutí), a má tedy vyšší teplotu vznícení.
Pěticentová (případně jedno- nebo dvoucentová) mince a naše desetikoruna vypadají, že jsou měděné. Vzhledem k tomu, že je měď relativně měkký kov, by však mince nebyly dostatečně pevné. Ve skutečnosti mají jádro z oceli, které je galvanicky poměděné.
Možná vás napadlo, že při pokusu vlastně dochází poškozování, a tedy pozměňování mincí české nebo evropské měny. Mohlo by se tedy jednat o naplnění skutkové podstaty trestného činu padělání a pozměnění peněz podle § 233 trestního zákoníku se sazbou jeden až tři roky odnětí svobody. Ale každý chemik přece ví, že katalyzátor se při chemické reakci nespotřebovává, ale pouze ji urychluje! Co tedy udělat se zčernalou mincí po experimentu? Opět poradí chemik. Stačí ji znovu zahřát v plameni kahanu a ponořit pod hladinu acetonu. První krok – reakce acetonu s oxidem měďnatým proběhne a tím se obnoví růžový povrch mědi. Ale protože vzduch, tedy ani kyslík, už k povrchu mince nemá přístup, reakce se zastaví (kromě toho kapalný aceton minci ochladí). Výsledkem je krásně růžová mince, která je čistší a hezčí, než byla na začátku experimentu a všechno je v pořádku.
-pH-
Škola chemie v přírodě pro žáky ZŠ a SŠ
Bude je jednat o týdenní pobyty, kdy dva učitelé chemie (fyziky, biologie…) na svojí škole sestaví skupinu 24–30 žáků/studentů, kteří mají zájem o chemii a přírodní vědy. Nemusí se jednat o stejně staré žáky, naopak kombinace nejmladších a maturantů umožní vrstevnické učení. Stejně tak je možné, že se domluví třeba dvě nebo tři školy, aby termín společně obsadily. Třída bude rozdělena na dvě poloviny a vždy jedna skupina bude v laboratoři a druhá skupina může mít výuku v učebně, odebírat vzorky vody, vzduchu, půdy v terénu, sportovat nebo mít biologickou či geologickou exkurzi do okolní přírody. Na večer můžeme pozvat zajímavé přednášející, realizovat volitelné úlohy v laboratoři, udělat kino, hrát deskové hry, nebo cokoliv podle dohody. Laboratorní práce budou připraveny Ústavem učitelství chemie a jejich nabídka se bude průběžně rozšiřovat. Laboratoře povedou asistenti z VŠCHT s výpomocí studentů učitelství chemie. S volnočasovým programem učitelům podle domluvy také rádi pomohou studenti VŠCHT.
V první fázi předpokládáme termíny v době září–říjen a duben–červen, po dobudování celoroční ubytovací kapacity pak i v průběhu celé zimy. Cena za pobyt se bude odvíjet od reálných nákladů za ubytování, stravování a energie.

Potaš z dřevného popela
Postup
Tipy a triky
- Popel musí být suchý, abychom dokázali vypočítat výtěžek, ale hlavně nesmí být zmoklý, protože pak by z něj byla většina rozpustných látek včetně uhličitanu draselného vyplavena.
- Pokud máte k dispozici pícku, můžete surovou potaš vyžíhat v ní.
- Množství získané potaše závisí na pečlivosti práce a typu dřeva, ze kterého popel pochází – nejlepší výtěžky poskytuje popel z tvrdého dřeva (bukového, dubového), naproti tomu popel z bylin obsahuje jako hlavní alkalickou složku uhličitan sodný neboli sodu.
Inkoust z duběnek
Pomůcky: vysoká kádinka 400 ml, hodinové sklo, velká třecí miska s tloučkem nebo hmoždíř, míchačka s ohřevem nebo elektrický vařič, filtrační aparatura, skleněná tyčinka, uzavíratelná nádoba na hotový inkoust
Chemikálie: suché duběnky, FeSO4·7H2O (zelená skalice), arabská guma, hřebíček
Postup
Asi 15 g suchých duběnek roztlučeme na malé kousky, vložíme do kádinky, přidáme 150 ml vody, zakryjeme hodinovým sklem a vaříme 2 hodiny. Směs necháme zchladnout a zfiltrujeme. Do filtrátu přidáme 5 g arabské gumy a mícháme do rozpuštění. Přidáme 6 g zelené skalice, směs ztmavne, a opět mícháme do rozpuštění. Hotový inkoust přelijeme do uzavíratelné nádoby a přidáme 2 hřebíčky jako konzervační činidlo.
Tipy a triky
- Po přípravě inkoust vyzkoušíme – pokud je příliš světlý, zahustíme ho svařením na menší objem, pokud je příliš řídký a nedrží na peru, je možné přidat víc arabské gumy.
- Arabská guma je pevná přírodní pryskyřice, která svým vzhledem připomíná jantar. Je to ve vodě rozpustná a lehce stravitelná směs sacharidů a glykoproteinů, v potravinářství se pod označením E414 používá jako stabilizátor. Získává se ze severoafrických akácií a je možné ji koupit v prodejně výtvarných potřeb.
- Podrobnější informace o historii používání duběnkového inkoustu a problémech spojených s korozí papíru způsobenou jeho použitím naleznete v článku v časopisu Vesmír.
-pH-
Kaštanové izomery
Strukturní nebo též konstituční izomery jsou sloučeniny, jejichž molekuly mají stejný počet atomů všech prvků, tedy stejný sumární vzorec, ale liší se různým uspořádáním vazeb mezi nimi.
Úkolem vaší pracovní skupiny je co nejrychleji prakticky ověřit, kolik existuje konstitučních izomerů heptanu (C7H16). K sestavení modelů jejich molekul využijte veřejnosti dobře známý, avšak v odborné chemii zřídka využívaný přístup nazývaný „kaštanová zvířátka“. Při sestavování modelů molekul z poskytnutého materiálu je nezbytné se řídit všemi níže uvedenými pravidly. Poté, co model sestavíte, nahlaste svoje řešení spolu se správným systematickým názvem izomeru učiteli, a po jeho schválení model vystavte na vyhrazené lavici. V případě, že je váš model správný a zároveň doposud není mezi vystavenými variantami, získává váš tým bod. Vítězem se stává tým, který nasbírá největší počet bodů.
Pravidla pro sestavování modelů:
- K sestavování modelů molekul izomerů využívejte pouze kaštany a špejle či párátka. Při propojování si můžete pomoci špičatým předmětem jako je hřebík, nůžky nebo kružítko.
- Vytvářejte pouze model uhlíkové kostry příslušné molekuly – kaštany představují atomy uhlíku a špejlemi budete modelovat pouze kovalentní vazby mezi nimi. Atomy vodíku tento model pro přehlednost nezobrazuje.
- Ke každému kaštanu mohou být pomocí špejlí připojeny nejvýše 4 jiné kaštany.
- Nesmíte tvořit kruhy.
- Na úhlech vazeb nezáleží.
- Zrcadlový obraz se považuje za model molekuly totožného izomeru.
-jh-
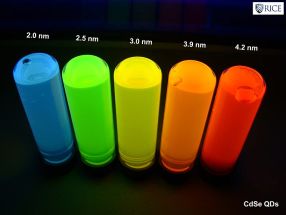
Kvantové tečky
V hodinách chemie a fyziky na základních a středních školách se žáci a studenti dozvídají, že každá chemicky čistá látka, prvek nebo sloučenina, má charakteristické fyzikální a chemické vlastnosti – třeba teplotu tání, barvu, reaktivitu – dané jejím složením a strukturou (třeba fosfor je prvek tvořený pouze atomy jednoho druhu, ale existují různé alotropické modifikace s velmi odlišným vzhledem, reaktivitou a toxicitou danou různým uspořádáním atomů a vazeb mezi nimi – fosfor bílý, červený a černý). Přitom první náznaky, že vlastnosti prvků a sloučenin mohou záviset na velikosti jejich částic, se objevily pozoruhodně brzo.

Nejznámějším příkladem je Lykurgův pohár pocházející ze starověkého Říma, uložený dnes v Britském muzeu v Londýně. Jedná se o skleněný pohár na bronzové noze, který má velmi zajímavou vlastnost – v odraženém světle má sklo zelenou, ale v procházejícím červenou barvu. Při zkoumání skla fyzikálně-chemickými metodami vědci zjistili, že je toto chování způsobeno přítomností nanočástic slitiny stříbra a zlata o velikosti asi 70 nm. Přitom stříbro je stříbřitý, zlato žlutý kov a klenotníci potvrdí, že barva slitin těchto dvou kovů se mění spojitě od stříbrné po zlatou podle jejich složení a zastoupení obou prvků.
Podobně překvapivým materiálem je zlatý purpur, známější pod označením Cassiův purpur. Už v polovině 17. století objevil alchymista, chemik a lékárník Johann Rudolf Glauber (jehož jméno známe z triviálního názvu dekahydrátu síranu sodného – Glauberova sůl), že rozpuštěním zlata v lučavce královské a redukcí vzniklého roztoku cínatou solí vzniká purpurové zbarvení. Pravděpodobně netušil, že je způsobené nanočásticemi zlata. Tuto formu kovu v roce 1673 znovu objevil německý lékař Andreas Cassius, a protože byla záhy komerčně využita k výrobě slavného rubínově zbarveného skla, byla pojmenována po něm.



Představme si, že máme hroudy čistého zlata, nugety, jejich velikost budeme postupně zmenšovat. V určitém okamžiku začnou být tak malé, že je pouhým okem přestaneme vidět. Dokud budou ale částice pozorovatelné optickým mikroskopem, znamená to, že jejich rozměry nejsou menší než v řádu mikrometrů a jejich vlastnosti (třeba barva pozorovaná v mikroskopu) jsou stejné jako vlastnosti výchozího nugetu. V tom případě se v angličtině používá označení bulk metal, čemuž v češtině asi nejlépe odpovídá označení „masivní kov“, ve smyslu velkého kusu kovu. Pokud částice zmenšíme ještě více, na velikost 100 až 1 nm, bude na jejich pozorování potřebný elektronový mikroskop a hovoříme o nanočásticích (to je případ částic Cassiova purpuru). Pokud budeme ve zmenšování pokračovat a dostaneme se pod velikost několika nanometrů, získáme klastr (z angličtiny, česky shluk, i když toto slovo se v chemii pro označení částic nepoužívá). Příkladem je pěkný symetrický klastr zlata Au16 na obrázku. Pokud dále zmenšíme velikost částice, získáme molekulu, např. nejjednodušší molekulu zlata Au2. Je třeba upozornit, že mezi nanočásticemi a klastry, a stejně tak mezi klastry a molekulami není ostrá hranice, používání termínů není striktně vázáno na velikost částic nebo počet atomů a je zvyklostí v konkrétním vědním oboru.
A co jsou to tedy kvantové tečky? Jsou to „částice polovodičů o velikosti několika nanometrů, jejichž optické a elektronové vlastnosti se v důsledku kvantově mechanických jevů liší od vlastností větších částic“ (používá se i označení polovodičové nanokrystaly). Jednou podmínkou je tedy velikost, jsou to malé nanočástice, a druhou podmínkou je, že jsou z materiálu, který je polovodičem. To způsobí, že elektronovou strukturu kvantových teček nemůžeme popsat pomocí pásové teorie, jak je zvykem pro kovy a polovodiče, ale pomocí diskrétních elektronových hladin, jak jsme zvyklí u molekul a atomů (představte si diagram energií atomových nebo molekulových orbitalů). To je důsledek právě relativně malého počtu částic v kvantové tečce. Jiný pohled na věc vychází z poměru počtu atomů přítomných na povrchu a uvnitř částice. U „velkých“ částic (větších, než jsou nanočástice) je počet povrchových atomů oproti těm vnitřním zanedbatelný. To je také základ pro popis pomocí pásové teorie, kdy předpokládáme pravidelnou krystalovou strukturu nekonečných rozměrů (povrch částice, kde tato pravidelnost končí, je tak vlastně hlavní poruchou struktury). A právě fakt, že se diskrétní elektronová struktura kvantových teček liší od pásové struktury „masivních“ částic polovodičů, způsobuje odlišné vlastnosti. A co víc, tyto vlastnosti se dají vyladit velikostí kvantové tečky.
Hlavním projevem výše popsaných jevů je závislost vlnové délky (tedy barvy) světla emitovaného kvantovou tečkou při
Nejrozšířenější každodenní aplikací kvantových teček je technologie QD-LCD (Quantum Dot Liquid Crystal Display), používaná v nejnovějších televizorech a monitorech. Běžná LED technologie využívá jako zdroje světla bílé LED diody, před kterými jsou barevné filtry (RGB) z kapalných krystalů. Ty se v každém pixelu (bodu obrazovky) mohou více či méně zapnout a vypnout, a tím vytvoří potřebnou barvu. Právě to, že se světlo částečně stíní barevnými filtry, je hlavním nedostatkem této technologie – nedostatečný jas obrazovky např. při silnějším osvětlení místnosti. To se dá částečně vyřešit podsvícením celého displeje, pak zase vyvstává problém s kontrastem a zobrazením „černé“ barvy (i při zobrazení černé displej stále trochu svítí). Oba tyto problémy elegantně řeší použití kvantových teček ve spojení s budicími modrofialovými LED diodami. Zdrojem světla příslušné barvy je pak samotná kvantová tečka, světlo není ničím filtrováno a displej má vysoký jas. Zároveň je možné budicí diody vypnout, pak zhasnou i kvantové tečky, pixel je opravdu černý a displej má zároveň vysoký kontrast.
-pH-
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 74095 [canonical_url] => [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2023-10 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [73252] => stdClass Object ( [nazev] => Inspirace 3U – září 2023 [seo_title] => Inspirace 3U – září 2023 [seo_desc] => [autor] => [autor_email] => [obsah] =>Mangan chameleonem
Pomůcky: kádinka 150 ml, odměrný válec 50 ml
Chemikálie: 0,002 mol dm–3 roztok KMnO4, 0,1 mol dm–3 roztok NaOH, neobarvené lízátko z hroznového cukru
Postup
Do kádinky nalijeme 100 ml roztoku KMnO4 a přidáme 20 ml roztoku NaOH. Obsah kádinky začneme míchat lízátkem a pozorujeme barevné změny.

Tipy a triky
- Lízátka z nebarveného hroznového cukru („Traubenzucker“) se dají koupit ve většině lékáren, někdy i v drogérii. Je lepší použít neobarvené lízátko, aby to nevypadalo, že barevné změny způsobuje barvivo.
- Koncentrace roztoku manganistanu a hydroxidu nejsou kritické. Vyšší koncentrace manganistanu způsobuje intenzivnější, ale pomaleji se měnící barvy roztoku. Vyšší koncentrace hydroxidu urychlí změny barev, nižší koncentrace může způsobit, že se neobjeví modrá barva. Obojí má vliv na intenzitu a odstín barev, můžete experimentovat.
Vysvětlení
Manganistan draselný je pevná iontová látka, která je zbarvená tak intenzivně, že se v pevném stavu jeví skoro černá s fialovým, kovovým nádechem. I při velmi malé koncentraci 0,002 mol dm–3, použité v experimentu, je roztok stále zřetelně fialově zbarven. Důvodem barevnosti sloučenin přechodných kovů jsou často tzv. d–d přechody elektronů mezi d-orbitaly centrálního atomu (např. zbarvení modré a zelené skalice). V případě manganistanového aniontu jsou to však tzv. pásy přenosu náboje neboli CT-pásy (z angl. charge transfer). Díky vysokému oxidačnímu stavu se centrální atom (M+VII) snadno redukuje (manganistan je silné oxidační činidlo). Absorpce fotonu probíhá tak, že se jeho energie využije na přenos elektronu („náboje“) z jednoho z oxidových aniontů (ligandů) na centrální atom, formálně tedy dojde k redukci centrálního atomu a k oxidaci ligandu o jednotku. Takové CT-pásy označujeme jako L→M (elektron přechází z ligandu na atom kovu). A protože maximum absorpce viditelného záření leží při 530 nm (viz obr.), absorbuje se zelené světlo a nám se manganistan jeví v komplementární barvě – vidíme ho jako fialový. Typickým rysem CT-pásů jsou vysoké hodnoty molárních absorpčních koeficientů a tomu odpovídající intenzivní zbarvení sloučenin. Kromě manganistanu jsou CT-pásy odpovědné za žlutou barvu chromanů, oranžovou barvu dichromanů, ale také za barvy ostatních oxoaniontů manganu.
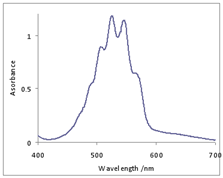
Redukcí manganistanu v zásaditém prostředí (v našem případě fruktosou – její oxidací dochází zároveň ke štěpení molekuly za vzniku směsi produktů, proto neuvádíme úplné chemické rovnice) vzniká zeleně zbarvený manganan MnO42–. Další redukcí může vznikat modře zbarvený manganičnan MnO43–, je ale potřeba silně zásadité prostředí, jinak se okamžitě rozkládá disproporcionací. Další redukcí výše uvedených oxoaniontů nebo jejich rozkladem ve slabě zásaditém prostředí vzniká nerozpustný oxid manganičitý neboli burel, pyroluzit. Ten je jako čistá látka nebo nerost zbarven hnědě až černě. Za podmínek našeho experimentu vzniká v malém množství jako jemná sraženina a je zodpovědný za konečnou žlutou až oranžovou barvu roztoku (přesněji suspenze).
Jak je tedy možné, že pozorované pořadí barev roztoku je fialová → modrá → zelená, když pořadí barev redukcí vznikajících oxoaniontů je fialová (MnO4–) → zelená (MnO42–) → modrá (MnO43–)? Odpověď je jednoduchá – ve slabě bazickém prostředí modrý manganičnan vůbec nevzniká a modrá barva vzniká kombinací fialové barvy nezreagovaného manganistanu a vznikajícího zeleného mangananu. Anebo na to můžeme jít obráceně. Kdyby v roztoku postupnou redukcí manganičitan vznikal, musela by zelená předcházet modré, a to se neděje. Poslední nepříliš výrazná barevná změna ze žluté na oranžovou už nesouvisí se změnou oxidačního stavu, ale se sbalením koloidních částic vzniklého MnO2 do větších částic. Chemické děje při experimentu můžeme tedy schematicky zapsat takto:
MnO4– → MnO42– → MnO2
fialová → zelená → oranžová
Na rozdíl od chameleona na bázi vanadu funguje experiment pouze v zásaditém prostředí. Manganan není v kyselém prostředí stabilní, vůbec nevzniká a modrou a zelenou barvu pozorovat nemůžeme. V kyselém prostředí může navíc docházet k redukci až na manganaté ionty. Ty jsou ve vodném roztoku zbarveny velmi slabě růžově (způsobuje d–d, nikoliv CT-přechod) a při použité koncentraci roztoku manganistanu by se nám vzniklý roztok jevil jako bezbarvý.
Kovový chameleon
Tradiční pokus s tímto názvem je založen na barevných změnách při postupné redukci vanadu z oxidačního čísla +V zinkem v prostředí kyseliny sírové (návod např. zde). Výchozí žlutá barva roztoku je způsobená kationtem VO2+, který se postupně redukuje na modrý VO2+, zelený V3+ a nakonec fialový V2+.
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 73252 [canonical_url] => [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2023-09 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) [73251] => stdClass Object ( [nazev] => Inspirace 3U – červen 2023 [seo_title] => Inspirace 3U – červen 2023 [seo_desc] => [autor] => [autor_email] => [obsah] =>Fiat lux! Luminiscence eskulinu z kaštanu
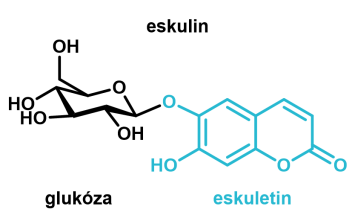
Jírovec maďal (Aesculus hippocastanum), lidově kaštan, je okrasný strom běžně rostoucí v alejích a parcích České republiky. Využívá se v přírodní medicíně k léčbě křečových žil, hemoroidů, snižuje svědění při ekzému a urychluje vstřebávání modřin. Všechny tyto účinky způsobuje velmi zajímavá látka přítomná v kůře stromu – eskulin. Tato látka je sekundárním metabolitem ve všech kaštanech rodu Aesculus, podle kterého byla pojmenována, ale největší obsah (až 40 mg/g kůry) má právě nejběžnější kaštan pěstovaný u nás. Eskulin je glykosid skládající se z eskuletinu s kumarinovým skeletem vázaného na glukózu (Obr. 1). Je to bílá pevná látka, která ve formě vodného roztoku vykazuje při UV osvětlení silnou modrou fluorescenci. A právě tato vlastnost se dá jednoduše využít pro krásný demonstrační pokus.


Pomůcky
větvička z kaštanu, kádinka s vodou, nůž, UV baterka
Postup
Z kaštanové větvičky seřízneme podélně proužky hnědé kůry. Seříznuté části větvičky při osvětlení UV baterkou po obvodu řezu vykazují silnou modrou fluorescenci (Obr. 2). Proužky kůry i ořezanou větvičku hodíme pod UV osvětlením do kádinky s vodou. Pozorujeme silnou fluorescenci eskulinu rozpouštějícího se do vody (Obr. 3).
Tipy a triky
- Kádinka nebo jiná skleněná nádoba nesmí sama pod UV fluoreskovat – vyzkoušet před samotným experimentem.
- Použít se dá jakýkoliv zdroj UV záření, např. lampička na kontrolu bankovek nebo UV lampa na umělé nehty. Nejlepší je ale použít UV baterku s kvalitním filtrem viditelného světla, např. typ Convoy S2 z AliExpressu za necelých 20 $.
3D-periodická tabulka s elektronegativitou
 Elektronegativita je základní veličinou vyjadřující afinitu atomů prvků k valenčním elektronům. Při výuce chemie se s ní seznamují už žáci na ZŠ a naučí se jí využívat pro posouzení polarity chemické vazby. Na střední a vysoké škole pak přibydou trendy elektronegativity v rámci periodické tabulky. A protože platí, že vždycky je lepší graf, než tabulka s čísly, nabízíme zdrojový soubor pro vytvoření takového sloupcového grafu na 3D-tiskárně.
Elektronegativita je základní veličinou vyjadřující afinitu atomů prvků k valenčním elektronům. Při výuce chemie se s ní seznamují už žáci na ZŠ a naučí se jí využívat pro posouzení polarity chemické vazby. Na střední a vysoké škole pak přibydou trendy elektronegativity v rámci periodické tabulky. A protože platí, že vždycky je lepší graf, než tabulka s čísly, nabízíme zdrojový soubor pro vytvoření takového sloupcového grafu na 3D-tiskárně.
Pokud 3D-tiskárnu nemáte, můžete využít prostorové zobrazení takovéto formy periodické tabulky, se kterým je možné po vložení do PowerPointové prezentace otáčet. Navíc je přidána barevná škála vyjadřující růst elektronegativity od zelené přes žlutou po červenou. Na první pohled je pak vidět, že elektronegativita obecně stoupá od kovů k nekovům, proč jsou vzácné plyny skutečně inertní, nebo že kovem s nejvyšší elektronegativitou je trochu překvapivě zlato.
[urlnadstranka] => [ogobrazek] => [pozadi] => [poduzel] => Array ( ) [iduzel] => 73251 [canonical_url] => //kuhv.vscht.cz/cinnosti/3u/inspirace/2023-06 [skupina_www] => Array ( ) [url] => /cinnosti/3u/inspirace/2023-06 [sablona] => stdClass Object ( [class] => stranka [html] => [css] => [js] => [autonomni] => 1 ) ) ) [sablona] => stdClass Object ( [class] => stranka_ikona [html] => [css] => [js] => [autonomni] => 1 ) [api_suffix] => )