Mangan chameleonem
Pomůcky: kádinka 150 ml, odměrný válec 50 ml
Chemikálie: 0,002 mol dm–3 roztok KMnO4, 0,1 mol dm–3 roztok NaOH, neobarvené lízátko z hroznového cukru
Postup
Do kádinky nalijeme 100 ml roztoku KMnO4 a přidáme 20 ml roztoku NaOH. Obsah kádinky začneme míchat lízátkem a pozorujeme barevné změny.

Tipy a triky
- Lízátka z nebarveného hroznového cukru („Traubenzucker“) se dají koupit ve většině lékáren, někdy i v drogérii. Je lepší použít neobarvené lízátko, aby to nevypadalo, že barevné změny způsobuje barvivo.
- Koncentrace roztoku manganistanu a hydroxidu nejsou kritické. Vyšší koncentrace manganistanu způsobuje intenzivnější, ale pomaleji se měnící barvy roztoku. Vyšší koncentrace hydroxidu urychlí změny barev, nižší koncentrace může způsobit, že se neobjeví modrá barva. Obojí má vliv na intenzitu a odstín barev, můžete experimentovat.
Vysvětlení
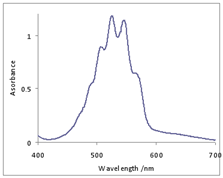
Manganistan draselný je pevná iontová látka, která je zbarvená tak intenzivně, že se v pevném stavu jeví skoro černá s fialovým, kovovým nádechem. I při velmi malé koncentraci 0,002 mol dm–3, použité v experimentu, je roztok stále zřetelně fialově zbarven. Důvodem barevnosti sloučenin přechodných kovů jsou často tzv. d–d přechody elektronů mezi d-orbitaly centrálního atomu (např. zbarvení modré a zelené skalice). V případě manganistanového aniontu jsou to však tzv. pásy přenosu náboje neboli CT-pásy (z angl. charge transfer). Díky vysokému oxidačnímu stavu se centrální atom (M+VII) snadno redukuje (manganistan je silné oxidační činidlo). Absorpce fotonu probíhá tak, že se jeho energie využije na přenos elektronu („náboje“) z jednoho z oxidových aniontů (ligandů) na centrální atom, formálně tedy dojde k redukci centrálního atomu a k oxidaci ligandu o jednotku. Takové CT-pásy označujeme jako L→M (elektron přechází z ligandu na atom kovu). A protože maximum absorpce viditelného záření leží při 530 nm (viz obr.), absorbuje se zelené světlo a nám se manganistan jeví v komplementární barvě – vidíme ho jako fialový. Typickým rysem CT-pásů jsou vysoké hodnoty molárních absorpčních koeficientů a tomu odpovídající intenzivní zbarvení sloučenin. Kromě manganistanu jsou CT-pásy odpovědné za žlutou barvu chromanů, oranžovou barvu dichromanů, ale také za barvy ostatních oxoaniontů manganu.
Redukcí manganistanu v zásaditém prostředí (v našem případě fruktosou – její oxidací dochází zároveň ke štěpení molekuly za vzniku směsi produktů, proto neuvádíme úplné chemické rovnice) vzniká zeleně zbarvený manganan MnO42–. Další redukcí může vznikat modře zbarvený manganičnan MnO43–, je ale potřeba silně zásadité prostředí, jinak se okamžitě rozkládá disproporcionací. Další redukcí výše uvedených oxoaniontů nebo jejich rozkladem ve slabě zásaditém prostředí vzniká nerozpustný oxid manganičitý neboli burel, pyroluzit. Ten je jako čistá látka nebo nerost zbarven hnědě až černě. Za podmínek našeho experimentu vzniká v malém množství jako jemná sraženina a je zodpovědný za konečnou žlutou až oranžovou barvu roztoku (přesněji suspenze).
Jak je tedy možné, že pozorované pořadí barev roztoku je fialová → modrá → zelená, když pořadí barev redukcí vznikajících oxoaniontů je fialová (MnO4–) → zelená (MnO42–) → modrá (MnO43–)? Odpověď je jednoduchá – ve slabě bazickém prostředí modrý manganičnan vůbec nevzniká a modrá barva vzniká kombinací fialové barvy nezreagovaného manganistanu a vznikajícího zeleného mangananu. Anebo na to můžeme jít obráceně. Kdyby v roztoku postupnou redukcí manganičitan vznikal, musela by zelená předcházet modré, a to se neděje. Poslední nepříliš výrazná barevná změna ze žluté na oranžovou už nesouvisí se změnou oxidačního stavu, ale se sbalením koloidních částic vzniklého MnO2 do větších částic. Chemické děje při experimentu můžeme tedy schematicky zapsat takto:
MnO4– → MnO42– → MnO2
fialová → zelená → oranžová
Na rozdíl od chameleona na bázi vanadu funguje experiment pouze v zásaditém prostředí. Manganan není v kyselém prostředí stabilní, vůbec nevzniká a modrou a zelenou barvu pozorovat nemůžeme. V kyselém prostředí může navíc docházet k redukci až na manganaté ionty. Ty jsou ve vodném roztoku zbarveny velmi slabě růžově (způsobuje d–d, nikoliv CT-přechod) a při použité koncentraci roztoku manganistanu by se nám vzniklý roztok jevil jako bezbarvý.
Kovový chameleon
Tradiční pokus s tímto názvem je založen na barevných změnách při postupné redukci vanadu z oxidačního čísla +V zinkem v prostředí kyseliny sírové (návod např. zde). Výchozí žlutá barva roztoku je způsobená kationtem VO2+, který se postupně redukuje na modrý VO2+, zelený V3+ a nakonec fialový V2+.
