Inkoust z duběnek
Pomůcky: vysoká kádinka 400 ml, hodinové sklo, velká třecí miska s tloučkem nebo hmoždíř, míchačka s ohřevem nebo elektrický vařič, filtrační aparatura, skleněná tyčinka, uzavíratelná nádoba na hotový inkoust
Chemikálie: suché duběnky, FeSO4·7H2O (zelená skalice), arabská guma, hřebíček
Postup
Asi 15 g suchých duběnek roztlučeme na malé kousky, vložíme do kádinky, přidáme 150 ml vody, zakryjeme hodinovým sklem a vaříme 2 hodiny. Směs necháme zchladnout a zfiltrujeme. Do filtrátu přidáme 5 g arabské gumy a mícháme do rozpuštění. Přidáme 6 g zelené skalice, směs ztmavne, a opět mícháme do rozpuštění. Hotový inkoust přelijeme do uzavíratelné nádoby a přidáme 2 hřebíčky jako konzervační činidlo.
Tipy a triky
- Po přípravě inkoust vyzkoušíme – pokud je příliš světlý, zahustíme ho svařením na menší objem, pokud je příliš řídký a nedrží na peru, je možné přidat víc arabské gumy.
- Arabská guma je pevná přírodní pryskyřice, která svým vzhledem připomíná jantar. Je to ve vodě rozpustná a lehce stravitelná směs sacharidů a glykoproteinů, v potravinářství se pod označením E414 používá jako stabilizátor. Získává se ze severoafrických akácií a je možné ji koupit v prodejně výtvarných potřeb.
- Podrobnější informace o historii používání duběnkového inkoustu a problémech spojených s korozí papíru způsobenou jeho použitím naleznete v článku v časopisu Vesmír.
-pH-
Kaštanové izomery
Strukturní nebo též konstituční izomery jsou sloučeniny, jejichž molekuly mají stejný počet atomů všech prvků, tedy stejný sumární vzorec, ale liší se různým uspořádáním vazeb mezi nimi.
Úkolem vaší pracovní skupiny je co nejrychleji prakticky ověřit, kolik existuje konstitučních izomerů heptanu (C7H16). K sestavení modelů jejich molekul využijte veřejnosti dobře známý, avšak v odborné chemii zřídka využívaný přístup nazývaný „kaštanová zvířátka“. Při sestavování modelů molekul z poskytnutého materiálu je nezbytné se řídit všemi níže uvedenými pravidly. Poté, co model sestavíte, nahlaste svoje řešení spolu se správným systematickým názvem izomeru učiteli, a po jeho schválení model vystavte na vyhrazené lavici. V případě, že je váš model správný a zároveň doposud není mezi vystavenými variantami, získává váš tým bod. Vítězem se stává tým, který nasbírá největší počet bodů.
Pravidla pro sestavování modelů:
- K sestavování modelů molekul izomerů využívejte pouze kaštany a špejle či párátka. Při propojování si můžete pomoci špičatým předmětem jako je hřebík, nůžky nebo kružítko.
- Vytvářejte pouze model uhlíkové kostry příslušné molekuly – kaštany představují atomy uhlíku a špejlemi budete modelovat pouze kovalentní vazby mezi nimi. Atomy vodíku tento model pro přehlednost nezobrazuje.
- Ke každému kaštanu mohou být pomocí špejlí připojeny nejvýše 4 jiné kaštany.
- Nesmíte tvořit kruhy.
- Na úhlech vazeb nezáleží.
- Zrcadlový obraz se považuje za model molekuly totožného izomeru.
-jh-
Kvantové tečky
V hodinách chemie a fyziky na základních a středních školách se žáci a studenti dozvídají, že každá chemicky čistá látka, prvek nebo sloučenina, má charakteristické fyzikální a chemické vlastnosti – třeba teplotu tání, barvu, reaktivitu – dané jejím složením a strukturou (třeba fosfor je prvek tvořený pouze atomy jednoho druhu, ale existují různé alotropické modifikace s velmi odlišným vzhledem, reaktivitou a toxicitou danou různým uspořádáním atomů a vazeb mezi nimi – fosfor bílý, červený a černý). Přitom první náznaky, že vlastnosti prvků a sloučenin mohou záviset na velikosti jejich částic, se objevily pozoruhodně brzo.

Nejznámějším příkladem je Lykurgův pohár pocházející ze starověkého Říma, uložený dnes v Britském muzeu v Londýně. Jedná se o skleněný pohár na bronzové noze, který má velmi zajímavou vlastnost – v odraženém světle má sklo zelenou, ale v procházejícím červenou barvu. Při zkoumání skla fyzikálně-chemickými metodami vědci zjistili, že je toto chování způsobeno přítomností nanočástic slitiny stříbra a zlata o velikosti asi 70 nm. Přitom stříbro je stříbřitý, zlato žlutý kov a klenotníci potvrdí, že barva slitin těchto dvou kovů se mění spojitě od stříbrné po zlatou podle jejich složení a zastoupení obou prvků.
Podobně překvapivým materiálem je zlatý purpur, známější pod označením Cassiův purpur. Už v polovině 17. století objevil alchymista, chemik a lékárník Johann Rudolf Glauber (jehož jméno známe z triviálního názvu dekahydrátu síranu sodného – Glauberova sůl), že rozpuštěním zlata v lučavce královské a redukcí vzniklého roztoku cínatou solí vzniká purpurové zbarvení. Pravděpodobně netušil, že je způsobené nanočásticemi zlata. Tuto formu kovu v roce 1673 znovu objevil německý lékař Andreas Cassius, a protože byla záhy komerčně využita k výrobě slavného rubínově zbarveného skla, byla pojmenována po něm.



Představme si, že máme hroudy čistého zlata, nugety, jejich velikost budeme postupně zmenšovat. V určitém okamžiku začnou být tak malé, že je pouhým okem přestaneme vidět. Dokud budou ale částice pozorovatelné optickým mikroskopem, znamená to, že jejich rozměry nejsou menší než v řádu mikrometrů a jejich vlastnosti (třeba barva pozorovaná v mikroskopu) jsou stejné jako vlastnosti výchozího nugetu. V tom případě se v angličtině používá označení bulk metal, čemuž v češtině asi nejlépe odpovídá označení „masivní kov“, ve smyslu velkého kusu kovu. Pokud částice zmenšíme ještě více, na velikost 100 až 1 nm, bude na jejich pozorování potřebný elektronový mikroskop a hovoříme o nanočásticích (to je případ částic Cassiova purpuru). Pokud budeme ve zmenšování pokračovat a dostaneme se pod velikost několika nanometrů, získáme klastr (z angličtiny, česky shluk, i když toto slovo se v chemii pro označení částic nepoužívá). Příkladem je pěkný symetrický klastr zlata Au16 na obrázku. Pokud dále zmenšíme velikost částice, získáme molekulu, např. nejjednodušší molekulu zlata Au2. Je třeba upozornit, že mezi nanočásticemi a klastry, a stejně tak mezi klastry a molekulami není ostrá hranice, používání termínů není striktně vázáno na velikost částic nebo počet atomů a je zvyklostí v konkrétním vědním oboru.
A co jsou to tedy kvantové tečky? Jsou to „částice polovodičů o velikosti několika nanometrů, jejichž optické a elektronové vlastnosti se v důsledku kvantově mechanických jevů liší od vlastností větších částic“ (používá se i označení polovodičové nanokrystaly). Jednou podmínkou je tedy velikost, jsou to malé nanočástice, a druhou podmínkou je, že jsou z materiálu, který je polovodičem. To způsobí, že elektronovou strukturu kvantových teček nemůžeme popsat pomocí pásové teorie, jak je zvykem pro kovy a polovodiče, ale pomocí diskrétních elektronových hladin, jak jsme zvyklí u molekul a atomů (představte si diagram energií atomových nebo molekulových orbitalů). To je důsledek právě relativně malého počtu částic v kvantové tečce. Jiný pohled na věc vychází z poměru počtu atomů přítomných na povrchu a uvnitř částice. U „velkých“ částic (větších, než jsou nanočástice) je počet povrchových atomů oproti těm vnitřním zanedbatelný. To je také základ pro popis pomocí pásové teorie, kdy předpokládáme pravidelnou krystalovou strukturu nekonečných rozměrů (povrch částice, kde tato pravidelnost končí, je tak vlastně hlavní poruchou struktury). A právě fakt, že se diskrétní elektronová struktura kvantových teček liší od pásové struktury „masivních“ částic polovodičů, způsobuje odlišné vlastnosti. A co víc, tyto vlastnosti se dají vyladit velikostí kvantové tečky.
Hlavním projevem výše popsaných jevů je závislost vlnové délky (tedy barvy) světla emitovaného kvantovou tečkou při
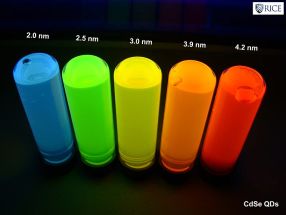
Nejrozšířenější každodenní aplikací kvantových teček je technologie QD-LCD (Quantum Dot Liquid Crystal Display), používaná v nejnovějších televizorech a monitorech. Běžná LED technologie využívá jako zdroje světla bílé LED diody, před kterými jsou barevné filtry (RGB) z kapalných krystalů. Ty se v každém pixelu (bodu obrazovky) mohou více či méně zapnout a vypnout, a tím vytvoří potřebnou barvu. Právě to, že se světlo částečně stíní barevnými filtry, je hlavním nedostatkem této technologie – nedostatečný jas obrazovky např. při silnějším osvětlení místnosti. To se dá částečně vyřešit podsvícením celého displeje, pak zase vyvstává problém s kontrastem a zobrazením „černé“ barvy (i při zobrazení černé displej stále trochu svítí). Oba tyto problémy elegantně řeší použití kvantových teček ve spojení s budicími modrofialovými LED diodami. Zdrojem světla příslušné barvy je pak samotná kvantová tečka, světlo není ničím filtrováno a displej má vysoký jas. Zároveň je možné budicí diody vypnout, pak zhasnou i kvantové tečky, pixel je opravdu černý a displej má zároveň vysoký kontrast.
-pH-
