Přiklopená svíčka
Co všechno ovlivňuje výšku hladiny při přiklopení svíčky nádobou?
Chemické složení svíčky
Svíčky se vyrábí nejčastěji z vosku (parafinového, včelího nebo rostlinného) nebo stearinu (rostlinného nebo živočišného). Nejlevnější a nejběžnější variantou je parafin získávaný rafinací ropy. Jedná se o směs nasycených alifatických uhlovodíků (alkanů) přibližně C20 až C40. Pro jednoduchost a základní úvahy o bilanci vznikajících produktů můžeme uvažovat svíčku z čistého parafinu o složení CnH2n+2. Vzhledem k tomu, že se vždy jedná o směs alkanů a počet atomů uhlíku je relativně vysoký, můžeme složení parafinu aproximovat stechiometrickým vzorcem CH2. Pak bude rovnice hoření následující:
2 CH2(s) + 3 O2(g) → 2 CO2(g) + 2 H2O(g)
Vzhledem k teplotě plamene svíčky (asi 800 °C) vzniká voda v podobě vodní páry (g). Pokud bychom přepokládali, že po uhasnutí svíčky počkáme tak dlouho, aby všechna voda zkondenzovala, pak ze 3 molů plynného kyslíku vznikají 2 moly plynného oxidu uhličitého. To je úbytek pouhých 7 % z celkového původního objemu vzduchu ve sklenici (obsah kyslíku ve vzduchu je 21 % obj., spotřebují se ho 2/3, tedy úbytek 7 %). To je příliš malá hodnota na vysvětlení pozorovaného úbytku objemu. (Pokud bychom připočítali zanedbané koncové atomy vodíku, zvýší se tato hodnota jen nepatrně.)
Kondenzace vody, zbytková vlhkost
Úvaha, že všechna vzniklá vodní pára zkondenzuje, také není přesná. Při zaklopení svíčky má vzduch vlhkost odpovídající vzduchu v místnosti, v zimě to může být ve vytápěném bytě 20 %, jinak se běžně pohybuje v rozmezí 40–60 %. Měřením se dá ukázat, že po skončení experimentu, když už se výška hladiny vody nemění, dosahuje hodnoty 70–80 %. Znamená to, že část vody vzniklé hořením zůstává v podobě páry a úbytek objemu vzduchu by měl být ještě menší než předchozí teoretická hodnota 7 %.
Rozpouštění CO2 ve vodě
Oxid uhličitý je omezeně rozpustný ve vodě a jeho rozpustnost silně závisí na jeho parciálním tlaku (tedy objemové koncentraci ve vzduchu, která se během experimentu mění) a teplotě. Hlavní je ale fakt, že rozpouštění do vody probíhá oproti době trvání experimentu pomalu a nemůže být zodpovědné za pohyb hladiny pozorovaný pouhým okem.
Tepelná roztažnost plynů
Doposud jsme neuvažovali, že hořící svíčka ohřívá vzduch v nádobě, ale hlavně generuje horký CO2 a vodní páru. Tedy ani v okamžiku přiklopení svíčky není možné předpokládat laboratorní teplotu vzduchu uvnitř nádoby. Přinejmenším, když svíčka zhasne, bude vzduch chladnout, zmenšovat svůj objem a významně přispívat ke zvýšení hladiny vody v nádobě. Ukazuje se, že vliv tepelné roztažnosti plynů je dominantní. Právě bublinky vzduchu unikající téměř vždy zpod nádoby při zaklopení jsou způsobeny ohříváním vzduchu uvnitř. Dalším důkazem je to, že hladina významně stoupá i potom, co svíčka zhasne (a kdy se přestane spotřebovávat kyslík). Navíc se před uhasnutím svíčky plamen významně zmenšuje, což snižuje rychlost nárůstu teploty plynů a chladnutí vzduchu v nádobě začíná dokonce už před zhasnutím plamene. Někdy je patrné, že po zhasnutí svíčky začne hladina stoupat skokově rychleji.
Neúplné spotřebování kyslíku
Zatím jsme předpokládali, že svíčka hoří tak dlouho, až se spotřebuje všechen kyslík. Tento předpoklad ale není samozřejmý. I pro hořlavé plyny (jako třeba methan) existuje určitá nutná minimální okolní koncentrace kyslíku, aby plyn dokázal hořet stabilním plamenem. Oprávněnost této námitky byla prokázána experimentálně tak, že do nádoby (zvonu) se svíčkou byla umístěna živá myš. Pokud by koncentrace O2 skutečně klesala k nule, bylo by to na chování myši poznat, v krajním případě by po delší době pokus nepřežila. Ve skutečnosti nebyla na myši ani po uhasnutí svíčky pozorována žádná výrazná změna chování. To by nasvědčovalo faktu, že se naopak velká část kyslíku nespotřebovala. I to bylo později pomocí elektronických čidel prokázáno, zbytková koncentrace O2 se pohybuje kolem hodnoty 17 % obj. To však znamená, že příspěvek úbytku kyslíku ke zvýšení hladiny je ještě výrazně menší než teoretická hodnota 7 % odpovídající jeho úplnému spotřebování.

Výška svíčky
Experimentálně bylo zjištěno, že za jinak stejných podmínek má vliv i výška svíčky. Čím je svíčka vyšší, tím hoří kratší dobu. Opět pomocí čidel byly měřeny koncentrace CO2 v průběhu experimentu v různých výškách nádoby. Nejvyšší nárůst koncentrace po přiklopení svíčky ukázalo měření v horní části nádoby přesto, že CO2 má vyšší hustotu než vzduch (jak se dá ukázat jinými experimenty se svíčkami). Vysvětlit se to dá tak, že na začátku vzniká horký CO2, který má hustotu menší než okolní vzduch, stoupá vzhůru a jeho koncentrace roste shora nádoby. Důsledkem toho vysoká svíčka zhasne jako první. Zajímavé je, že autoři neuvádějí vliv výšky svíčky na výšku hladiny v nádobě.
Nedokonalé spalování
Pokud se během experimentu plamen svíčky zmenšuje v důsledku zvyšování koncentrace CO2 a snižování koncentrace O2, bylo by možné uvažovat i částečné nedokonalé spalování parafinu za vzniku oxidu uhelnatého. V tomto případě by uhlík pro svoji oxidaci potřeboval polovinu kyslíku než při hoření na CO2:
1 C(s) + ½ O2 → 1 CO(g)
Dá se předpokládat, že pokud by se nedokonalé spalování uplatňovalo, tak jen relativně krátkou dobu před uhasnutím plamene. Spolu s faktem, že spotřeba kyslíku není hlavním faktorem ovlivňujícím konečnou výšku hladiny, to znamená, že vliv nedokonalého spalování bude jen velmi malý. Je třeba upozornit, že se jedná pouze o teoretickou úvahu, protože vznik CO (byť malého množství), nebyl experimentálně prokázán.
Na vánočním videu můžete vidět, že se experiment chová trochu jinak. Na začátku po přiklopení neunikají bublinky, plamen se zvětší a rozjasní a hoří nezvykle dlouho. Je to proto, že kádinka byla předem naplněna kyslíkem (nicméně plamen nehoří v čistém kyslíku, část ho při zaklopení vyteče).
Chemické vánoční stromečky
Chemikálie a pomůcky:
- dekahydrát tetraboritanu sodného (borax)
- zelený čistící dýmkový drát (lze koupit v kreativních potřebách)
- kádinka nebo zavařovací sklenice
- kancelářská sponka
- odměrný válec
- rychlovarná konvice
- špejle
- lžička
- navažovací lodička
- váhy
Postup

Tipy a triky:
- Roztok nevyléváme, uschováme ho v uzavřené popsané sklenici pro další krystalizaci. Pro další použití roztok přivedeme k varu v kádince a přidáme potřebné množství boraxu.
- Z dýmkového drátu můžeme vytvořit libovolné tvary a použít jako ozdoby na stromek.
- S pevným boraxem nemohou žáci ZŠ ani gymnázií pracovat ani pod dohledem učitele. Pro práci ve třídě doporučujeme následující rozdělení rolí: žáci vytvoří ozdoby z drátků a vyučující připraví nasycený roztok, do kterého připravené drátky ponoří.
- Jako žákovskou variantu lze využít například chlorid draselný. Jeho rozpustnost při 100 °C je 57 gramů na 100 gramů vody.
Skořicový aldehyd
Dvojná vazba přítomná v přírodním cinnamaldehydu má konfiguraci E (trans).
Cinnamaldehyd se snadno získá ze skořicové kůry destilací s vodní parou, případně aldolovou kondenzací benzaldehydu s acetaldehydem. Oba postupy jsou snadno proveditelné i ve školních laboratořích.
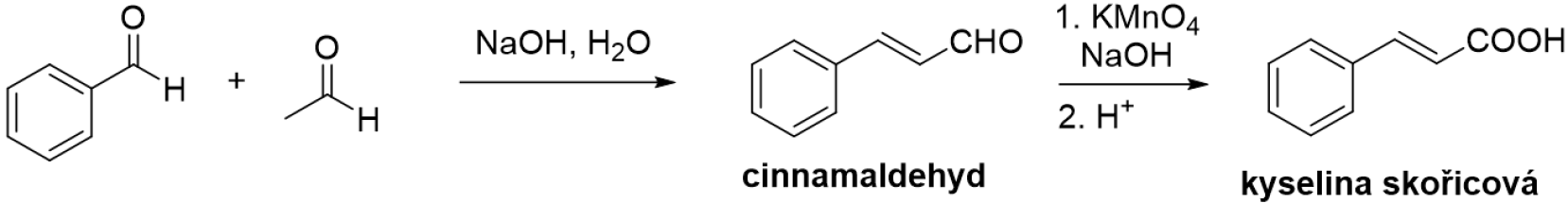
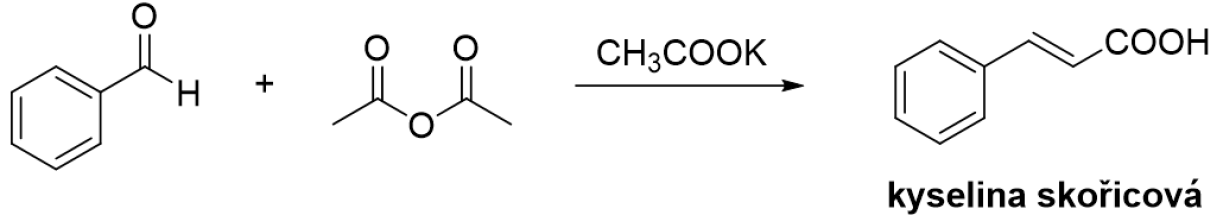
Kyselina skořicová se dá připravit oxidací cinnamaldehydu nebo Perkinovou reakcí z benzaldehydu a acetanhydridu v bazickém prostředí.
Věděli jste, že?
- Cinnamaldehyd je znám opravu dlouho – byl izolován ze skořicového esenciálního oleje J. Dumasem a E. Péligotem už v roce 1834 a laboratorně syntetizován L. Chiozzou v roce 1856.
- Čistý cinnamaldehyd dráždí kůži a ve větších dávkách je toxický (LD50 2 225 mg/kg pro myš, 2 220 mg/kg pro potkana).
- Skořice podporuje chuť k jídlu a zlepšuje trávení.
- V řadě kuchyní (asijské, latinskoamerické, arabské, španělské…) se skořice přidává do masitých pokrmů.
- Cinnamaldehyd byl využit i při falšování potravin. Bukvicové skořápky umleté na prášek a aromatizované cinnamaldehydem bývají vydávány za mletou cejlonskou skořici.
-pm-
